题目内容
【题目】下表为元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
四 | ⑨ | ⑩ |
(1)写出元素符号:②________,⑦_______。
(2)①的原子结构示意图为_________,⑤的离子结构示意图为________。
(3)元素⑨的最高价氧化物对应的水化物的电子式为________。
(4)元④、⑧、⑩的氢化物的沸点由高到低的顺序为_________(填化学式)。
(5)写出元素③和⑥形成的化合物与元素⑤的最高价氧化物对应的水化物反应的化学方程式_____________。
【答案】N Si 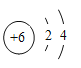
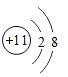
![]() HF>HBr>HCl Al2O3+2NaOH=2NaAlO2+H2O
HF>HBr>HCl Al2O3+2NaOH=2NaAlO2+H2O
【解析】
根据乙酸在周期表的位置确定①--⑩号元素分别是C、N、O、F、Na、Al、Si、K、Br元素,然后根据元素的原子结构与元素的位置的关系推断其结构或化合物的性质,根据物质性质书写反应方程式。
根据乙酸在周期表的位置确定①--⑩号元素分别是C、N、O、F、Na、Al、K、Br元素。
(1)②号元素是氮元素,氮的元素符号是N,⑦号元素是硅元素,元素符号为Si。
(2)①号元素的C,C原子核外有6个电子,电子层排布为2、4,所以C的原子结构示意图为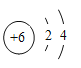 ,⑤号元素是Na,Na是11号元素,原子最外层有1个电子,容易失去,变为Na+。Na+的离子结构示意图为
,⑤号元素是Na,Na是11号元素,原子最外层有1个电子,容易失去,变为Na+。Na+的离子结构示意图为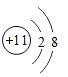 ;
;
(3)元素⑨是K,其的最高价氧化物对应的水化物KOH 离子化合物,K+与OH-通过离子键结合,其电子式为![]() ;
;
(4)元素④、⑧、⑩的氢化物分别是HF、HCl、HBr,由于在HF分子之间存在氢键,使分子之间作用力增强,物质的沸点增大,HCl、HBr结构相似,分子间作用力随相对分子质量的增大而增大,所以沸点HBr>HCl,所以这三种氢化物的沸点由高到低的顺序为HF>HBr>HCl;
(5)元素③和⑥形成的化合物Al2O3是两性氧化物,可以与强酸、强碱发生反应,元素⑤的最高价氧化物对应的水化物NaOH是一元强碱,二者反应产生偏铝酸钠和水,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】根据下列实验操作和现象能推出相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀 | AlO2-与HCO3-发生了相互促进的水解反应 |
B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X不一定具有氧化性 |
C | 灼热的木炭加入浓硝酸中,放出红棕色气体 | 一定是木炭与浓硝酸反应生成了NO2 |
D | 将乙醇与浓硫酸共热,制得的气体直接通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | 说明制得的气体中含有乙烯 |
A. A B. B C. C D. D