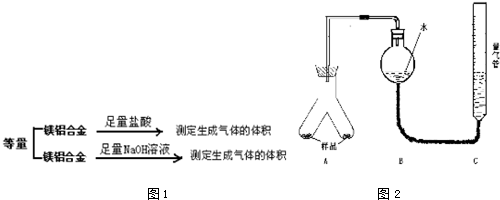
题目内容
20.已知NH3分子可与Cu2+形成配合物离子[Cu(NH3)4]2+,则除去硫酸铜溶液中少量硫酸可选用的试剂是( )| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
分析 除去硫酸铜溶液中少量硫酸,可加入能与硫酸反应且不能引入杂质的物质,则可用铜的氧化物、氢氧化物以及碳酸铜等物质,以此解答.
解答 解:A.氢氧化钠能和硫酸铜反应生成蓝色沉淀氢氧化铜,故A错误;
B.氨气容易和硫酸铜生成[Cu(NH3)4]2+,故B错误
C.氧化铜能和稀硫酸反应生成硫酸铜和水,可用于除杂,故C正确;
D.氯化钡能和硫酸铜反应生成硫酸钡白色沉淀,故D错误.
故选C.
点评 本题考查物质的分离和提纯,是基础性试题的考查,难度不大,为高考中的常见考点之一,该题有利于训练学生的答题能力,提高学生的学习兴趣和学习效率.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
10.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上常温下呈气态的化合物,则下列说法错误的是( )
| A. | X、Y、Z三种元素可以组成一种盐 | |
| B. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒都有2种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
15.为了检验某溴代烃中的溴元素,现进行如下操作,其中合理的是( )
| A. | 取溴代烃少许,加入AgNO3溶液 | |
| B. | 取溴代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取溴代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 | |
| D. | 取溴代烃少许与NaOH水溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 |
5.下列各组溶液中,不用任何试剂无法鉴别的是( )
| A. | NaCl、Na2CO3、NaI、AgNO3 | B. | HCl、Na2CO3、新制氯水、NaI | ||
| C. | Na2S、HCl、FeCl3、NaCl | D. | AlCl3、BaCl2、Na2CO3、H2SO4 |
12.下列关于卤族元素的叙述,不正确的是( )
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐减弱 | |
| C. | 单质与水反应均可表示为X+H2O=HX+HXO | |
| D. | 随核电荷数的增加卤素原子的半径递增,卤素离子的还原性增强 |
10.有A、B、C、D、E、F六种元素,已知:①它们位于三个不同短周期,核电荷数依次增大
②B与F同主族.
③B、C分别都能与D按原子个数比1:1或1:2形成化合物.
④A、E分别都能与D按原子个数比1:1或2:1形成化合物.
⑤E元素的电离能数据如表 (kJ•mol-1):
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式NaHCO3、CH3COONa.
(2)B2A4分子中存在5个σ键,1个π键.
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
试计算A单质与C单质反应生成CA3时的反应热△H=-90.8kJ•mol-1(要写单位).
②B与F同主族.
③B、C分别都能与D按原子个数比1:1或1:2形成化合物.
④A、E分别都能与D按原子个数比1:1或2:1形成化合物.
⑤E元素的电离能数据如表 (kJ•mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(2)B2A4分子中存在5个σ键,1个π键.
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
| 化学键 | A-A | C≡C | A-C |
| 键能/kJ•mol-1 | 436.0 | 946 | 390.8 |