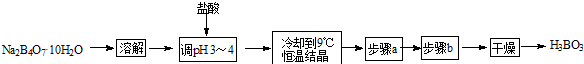
题目内容
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 元素A、B只能形成一种化合物 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,处于IA族,结合原子序数可知,C只能处于第三周期,故C为Na;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Na,只能处于第二周期,最外层电子数为4,则B为碳元素;A的原子序数小于碳,且单质为气体,故A为H元素;结合原子序数可知D、E处于第三周期,元素D的合金是日常生活中常用的金属材料,则D为Al;E的单质为气体,故E为Cl,据此解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,处于IA族,结合原子序数可知,C只能处于第三周期,故C为Na;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Na,只能处于第二周期,最外层电子数为4,则B为碳元素;A的原子序数小于碳,且单质为气体,故A为H元素;结合原子序数可知D、E处于第三周期,元素D的合金是日常生活中常用的金属材料,则D为Al;E的单质为气体,故E为Cl.
A.元素H、C形成烃类化合物,种类繁多,故A错误;
B.元素C、D的最高价氧化物对应的水化物分别为NaOH、氢氧化铝,二者反应生成偏铝酸钠与水,故B错误;
C.工业常用电解熔融氯化钠制备钠与氯气,电解饱和氯化钠溶液制备氯气,故C正确;
D.化合物HCl含有共价键,化合物NaCl含有离子键,二者含有化学键不同,故D错误,
故选C.
点评 本题考查结构性质位置关系及应用,元素的推断是解答的关键,C中注意掌握中学常见的化学工业,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列各组溶液中,不用任何试剂无法鉴别的是( )
| A. | NaCl、Na2CO3、NaI、AgNO3 | B. | HCl、Na2CO3、新制氯水、NaI | ||
| C. | Na2S、HCl、FeCl3、NaCl | D. | AlCl3、BaCl2、Na2CO3、H2SO4 |
12.下列关于卤族元素的叙述,不正确的是( )
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐减弱 | |
| C. | 单质与水反应均可表示为X+H2O=HX+HXO | |
| D. | 随核电荷数的增加卤素原子的半径递增,卤素离子的还原性增强 |
2.下列卤代烃,在一定条件下,能发生消去反应且产物只有一种的是( )
| A. | CH3Cl | B. | CH3-CHBr-CH3 | C. | 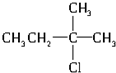 | D. | 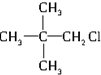 |
6.除去乙酸乙酯中含有的乙酸,最好的处理和操作是( )
| A. | 蒸馏 | B. | 水洗后分液 | ||
| C. | 用过量饱和碳酸钠溶液洗涤后分液 | D. | 用过量氢氧化钠溶液洗涤后分液 |
7.下列各项中表达正确的是( )
| A. | NH3分子的电子式: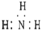 | B. | CH4分子的比例模型: | ||
| C. | O原子的结构示意图: | D. | N2的结构式:N≡N |