��Ŀ����
����Ŀ��(12��)��ʳ�γ���������K����Ca2����Mg2����Fe3����SO![]() ���������ӣ�ʵ�����ᴿNaCl���������£�
���������ӣ�ʵ�����ᴿNaCl���������£�
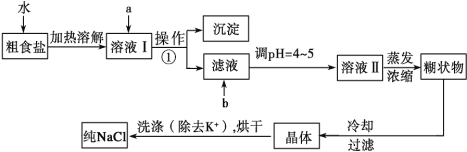
�ṩ���Լ�������Na2CO3��Һ������K2CO3��Һ��NaOH��Һ��BaCl2��Һ��Ba(NO3)2��Һ��75%�Ҵ������Ȼ�̼��ϡ���ᡣ
��1������ȥ��Һ���е�Ca2����Mg2����Fe3����SO![]() ��ѡ��a���������Լ������μ�˳������Ϊ____________________ (ֻ�ѧʽ)��
��ѡ��a���������Լ������μ�˳������Ϊ____________________ (ֻ�ѧʽ)��
��2����μ��� SO![]() �Ƿ������ȫ ��
�Ƿ������ȫ ��
��3������pH ��Ŀ�� ���Լ�b�� �������ƣ���
��4��ϴ�ӳ�ȥNaCl������渽��������KCl��ѡ�õ��Լ�Ϊ_________��ʹ�ø��Լ���Ŀ���� ��
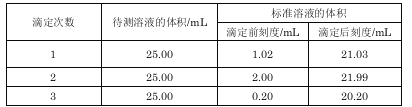
���𰸡�18��(ÿ��2������12��) (1��BaCl2��NaOH��Na2CO3(��NaOH��BaCl2��Na2CO3��BaCl2��Na2CO3��NaOH)����2�����ã����ϲ���Һ�У���ȡ�ϲ���Һ�������μ�BaCl2��Һ������������˵���ѳ�����ȫ����֮����δ������ȫ����3���к���Һ�й�����OH-��CO32-��ϡ�����4��75%�Ҵ�����ȥ�����������ʣ����پ������ġ�
��������
�����������1��Ҫ��ȥSO42-��ֻ��ѡBaCl2��Һ����ѡ��Ba��NO3��2���������µ�����NO3-����ѡ��NaOH��Һ��ȥMg2+��Fe3+��Һ�����ѡ��Na2CO3��Һ��ȥCa2+���˴�����ѡ��K2CO3��Һ������������µ�K+������HCl��ȥ������CO32-��Na2CO3��Һ���ܼ���BaCl2��Һǰ�����������Ba2+����Ϊ��BaCl2��NaOH��Na2CO3(��NaOH��BaCl2��Na2CO3��BaCl2��Na2CO3��NaOH)��2��������ӵ��Ȼ����������ģ�����Һ�к�����������ӣ�������������������ӻ����ɰ�ɫ��������Ϊ�����ã����ϲ���Һ�У���ȡ�ϲ���Һ�������μ�BaCl2��Һ������������˵���ѳ�����ȫ����֮����δ������ȫ����3�������������������NaOH��Һ����Na2CO3��Һ������Ӧ�������Ȼ��ơ�ˮ�Ͷ�����̼���壬��������pH ��Ŀ�����к���Һ�й�����OH-��CO32-���Լ�b��ϡ�����4���Ȼ��������Ҵ����Ҵ��ӷ���ϴ�ӳ�ȥNaCl������渽��������KCl��ѡ�õ��Լ�Ϊ75%�Ҵ�����Ϊ��75%�Ҵ���ʹ�ø��Լ���Ŀ���dz�ȥ�����������ʣ����پ������ġ�

 �Ķ��쳵ϵ�д�
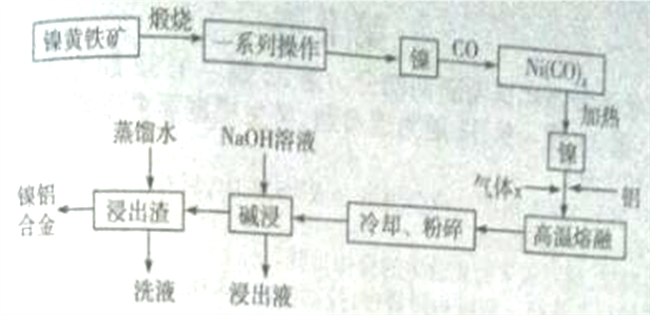
�Ķ��쳵ϵ�д�����Ŀ�������仯�����ڹ�ҵ����������;���ش������й����⣺
(1) FeCl3�����ڽ���ʴ�̡���ˮ�����ȡ���ҵ������FeCl3����NaClO3��������FeCl2��Һ�����е�����ΪFeCl2��FeCl3��HCl���Ʊ���
��д��NaClO3��������FeCl2��Һ�����ӷ���ʽ��_______________��
�ڲ��pH=2��FeCl2��Һ�У�c(Cl-)=5.3��10-2mol�� L-1��c(Fe3+)=1.0��10-3mol�� L-1����c(Fe2+)=____mol�� L-1������FeCl3��ij�������д�����1m3��FeCl2��Һ����Ӧ��ת�Ƶĵ���Ϊ_________mol��
(2)��ϵ�����������������ĵ��⡢��ѧ��������ʯ��ĥ����ϡ��������ϡ��뵼����ϵȷ�����Թ㷺Ӧ�á��ڿ����м���FeCO3���Ƶ���ϵ��������ϡ���֪��
��4Fe(s)+3O2(g)=2Fe2O3(s) ��H=-1648kJ��mol-1��
��C(s)+O2(g)= CO2(g) ��H=-393kJ��mol-1��
��2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ��H=-1480kJ��mol-1��
���ڿ����м���FeCO3������ϵ������Fe2O3���Ȼ�ѧ����ʽΪ_____________��
(3)��֪��ij�ֺ������������·������з�Ӧ��CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ��H<0��
CH4(g)+ H2O (g) ��H<0��
һ���¶��º�ѹǿ�����£���1molCO��3molH2���뵽ѹǿΪP0�ĺ�ѹ�ܱ������У���ò�ͬʱ��CO���������![]() (CO)���±���
(CO)���±���
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
�ٵ�______���ٷ����仯ʱ��д��һ�����ɣ��������CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)�ﵽƽ�⡣
CH4(g)+ H2O (g)�ﵽƽ�⡣
�ڴﵽƽ��ʱCO��ת����Ϊ________������ƽ���ѹ����ƽ��Ũ�ȣ�����¶��µ�ƽ�ⳣ��K=____����֪�������ѹ=������ѹ�������������
������ͼ�б�ʾ�÷�Ӧ��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ���¶�T1��T2��T3�ɸߵ��͵�˳����______________��