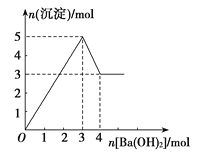
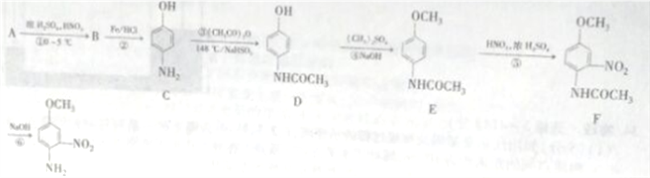
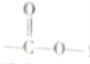
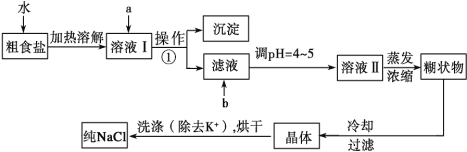
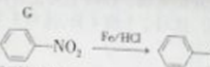题目内容
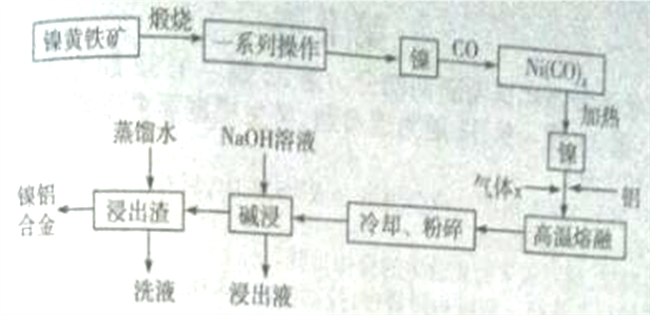
【题目】一种带有多孔结构的镍铝合金对H2具有较强的吸附性,其高催化活性和热稳定性使得该镍铝合金被用于很多工业过程中和有机合成反应中。下图是以镍黄铁矿(主要成分为NiS、FeS等)为原料制备该镍铝合金的工艺流程图:
回答下列问题:
(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,则Ni化合价为_______价。
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,写出Fe2O3的化学方程式________________。
(3)操作“镍![]() Ni(CO)4
Ni(CO)4![]() 镍”的目的是__________。
镍”的目的是__________。
(4) Ni、Al高温熔融时,气体x的作用是___________。对“高温熔融”物冷却后,需要进行粉碎处理,粉碎处理的目的是________________。
(5)“碱浸”可以使镍产生多孔结构,从而增强对H2的吸附性,“浸出液”中的主要离子是_____________;“浸出液”中的铝元素可循环利用,写出回收“浸出液”中的铝元素,并制备“高温熔融”时的原料Al的流程:_____________(示例:CuO![]() Cu2+
Cu2+![]() Cu)。
Cu)。
【答案】 0 4FeS+7O2 ![]() 2Fe2O3+4SO2 提纯镍 保护Ni、Al,防止其被氧化 增大接触面积,提高“碱浸“的反应速率 Na+、AlO2-或[Al(OH)4]-、OH-
2Fe2O3+4SO2 提纯镍 保护Ni、Al,防止其被氧化 增大接触面积,提高“碱浸“的反应速率 Na+、AlO2-或[Al(OH)4]-、OH- ![]()
【解析】本题考查化学工艺流程,涉及化学反应原理知识的应用,(1)CO化合价代数和为0,而Ni(CO)4中C和O的价态与CO中的相同,因此Ni的化合价为0;(2)FeS煅烧生成Fe2O3和SO2,反应方程式为:4FeS+7O2![]() 2Fe2O3+4SO2;(3)目的是提纯Ni;(4)需要制备镍铝合金,高温熔融时容易被氧气氧化,即熔融时通入气体x,防止Ni、Al氧化;粉碎目的是增大接触面积,提高“碱浸”的反应速率;(5)高温熔融中含有铝,Al与NaOH反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此含有的离子是Na+、AlO2-、OH-;
2Fe2O3+4SO2;(3)目的是提纯Ni;(4)需要制备镍铝合金,高温熔融时容易被氧气氧化,即熔融时通入气体x,防止Ni、Al氧化;粉碎目的是增大接触面积,提高“碱浸”的反应速率;(5)高温熔融中含有铝,Al与NaOH反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此含有的离子是Na+、AlO2-、OH-;![]() 。
。

【题目】下图是中学教材中元素周期表的一部分,其中标出A-Q14种元素,试回答下列问题:[(1) (2)问用具体的元素符号或离子符号或化学式回答]
A | B | C | D | ||||||||||||||
E | F | G | H | I | J | K | L | ||||||||||
P | Q |
(1)在上表所列出的短周期元素中
①性质最不活泼的是_______;②原子半径最大的是_____(除稀有气体元素)
③形成的气态氢化物最稳定的是_______;
④最高价氧化物对应的水化物中酸性最强的是_______碱性最强的是_______。
⑤形成的阴离子还原性最弱的是_______,阳离子半径最小的是_______。
(2)用电子式表示F与D形成化合物的过程
________________________________________________________________________;
(3)设P的原子序数为Z,则F的原子序数为___________,Q的原子序数为____________。
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。

(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。