题目内容
【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
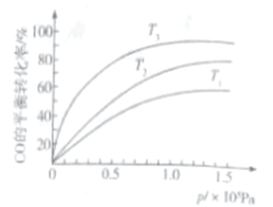
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
【答案】 ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 2.0×10-2 20 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH=-260kJ·mol-1 混合气体的密度或混合气体的平均相对分子质量或任一组分的体积分数等 33.3%或1/3 0.231/P02 T1>T2>T3
【解析】(1)①本题考查氧化还原反应方程式的书写,NaClO3中Cl化合价由+5价→-1价,化合价降低6价,Fe2+被氧化成Fe3+,化合价升高1价,最小公倍数为6,由:ClO3-+6Fe2+→Cl-+6Fe3+,溶液显酸性,根据原子守恒,离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;②本题考查化学计算,从电荷守恒和得失电子数目守恒入手,根据电荷守恒,2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-),代数数值,c(Fe2+)=2×10-2mol·L-1,Fe2+转化成Fe3+,失去1mol电子,因此溶液中共转移电子物质的量为1×103×2×10-2×1mol=20mol;(2)本题考查盖斯定律的应用,①+4×②-③×2得出:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=(-1648-4×393+2×1480)kJ·mol-1=-260kJ·mol-1;(3)本题考查达到化学平衡状态的判断、化学平衡的计算、影响化学反应速率的因素,①反应前后气体的物质的量不变,因此当气体物质的量不再改变,说明反应达到平衡;根据密度的定义,是恒压状态,气体体积改变,即当密度不再改变,说明反应达到平衡;根据化学平衡状态的定义,当某一组分的体积分数不再改变,说明反应达到平衡等;②CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)
CH4(g)+ H2O (g)
起始: 1 3 0 0
变化: x 3x x x
平衡: 1-x 3-3x x x ,达到平衡时,CO的体积分数为0.2,即有(1-x)/(1-x+3-3x+x+x)=0.2,解得x=1/3,CO的转化率为1/3,达到平衡氢气的体积分数为(3-3x)/(4-2x)=3/5,同理CH4的体积分数为1/10,H2O的体积分数为1/10,是恒压状态,CO的气体分压是P0×0.2,H2的气体分压是3P0/5,CH4、H2O的气体分压是P0/10,根据化学平衡常数的定义,K=p(CH4)×p(H2O)/根据化学平衡常数的定义,K=p(CH4)×p(H2O)/[p3(H2)×p(CO)],代入数值,K=0.231/P0;③正反应是放热反应,升高温度,平衡向逆反应方向移动,CO的转化率降低,即T1>T2>T3。