题目内容
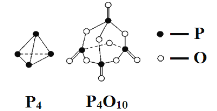
【题目】白磷与氧气可发生如下反应:P4+5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:E(P—P) = a kJ·mol-1、E(P—O) = b kJ·mol-1、E(P=O) = c kJ·mol-1、E(O=O) = d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.-(6a-12b-4c+5d)kJ·mol-1
B.-(-6a+12b+4c-5d)kJ·mol-1
C.-(-4a+6b+4c-5d)kJ·mol-1
D.-(4a-6b-4c+5d)kJ·mol-1
【答案】B
【解析】
试题分析:根据化学键和反应热的关系,△H=反应物键能总和-生成物键能总和=[6×a+5×d-(12b+4c)]kJ·mol-1,因为此磷的燃烧是放热反应,△H<0,△H=-(-6a+12b+4c-5d)kJ·mol-1,故选项B正确。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目