题目内容
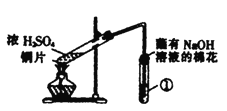
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项 | ①中试剂 | ①中现象 | 解释 |
|
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 | |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 | |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 | |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
A. A B. B C. C D. D
【答案】D
【解析】A.二氧化硫具有漂白性,能使品红溶液褪色,A正确;B.二氧化硫和水反应生成亚硫酸,亚硫酸的酸性强于硅酸,因此二氧化硫通入硅酸钠溶液中生成硅酸沉淀,B正确;C.二氧化硫能被酸性高锰酸钾溶液氧化,所以酸性高锰酸钾溶液褪色,则二氧化硫体现还原性,C正确;D.将SO2通入Ba(NO3)2溶液,发生氧化还原反应而有白色沉淀生成,白色沉淀为硫酸钡,不溶于硝酸,所以解释错误,D错误;答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
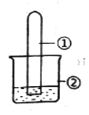
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D
【题目】
工业上常利用含硫废水生产Na2S2O3 ·5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程。实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品。
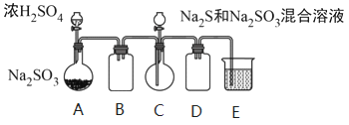
已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(b)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (c)
Na2S2O3(aq) (c)
ii.BaS2O3易溶于水。
(1)E中的试剂是__________。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为__________。
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是__________。
(4)产品中常含有Na2SO3和Na2SO4。该小组设计了以下实验方案进行检验。
步骤 | 实验操作 | 实验现象 |
Ⅰ | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
Ⅱ | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量__________ | 沉淀未完全溶解,并有刺激性气味的气体产生 |
①步骤Ⅱ中加入的试剂可以是__________(填序号)。
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤Ⅱ设计过滤操作的目的是(用化学方程式简要文字表述)__________。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是__________。
(6)Na2S2O3常用作脱氯剂。Na2S2O3溶液与Cl2反应的离子方程式为__________。
【题目】研究性学习小组利用下列有关装置进行探究实验,回答相关问题。
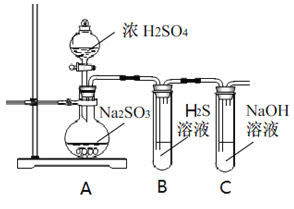

(1)写出A中的反应化学方程式_______________________________________________________
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是_________________________________。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有___性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
实验步骤 | 实验操作 | 预期现象与结论 |
_____ | _______________ | _______________ |
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验。该小组的实验目的是_________________________________。