题目内容
【题目】
工业上常利用含硫废水生产Na2S2O3 ·5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程。实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品。
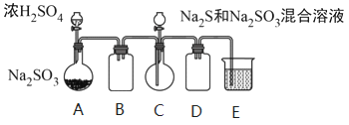
已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(b)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (c)
Na2S2O3(aq) (c)
ii.BaS2O3易溶于水。
(1)E中的试剂是__________。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为__________。
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是__________。
(4)产品中常含有Na2SO3和Na2SO4。该小组设计了以下实验方案进行检验。
步骤 | 实验操作 | 实验现象 |
Ⅰ | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
Ⅱ | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量__________ | 沉淀未完全溶解,并有刺激性气味的气体产生 |
①步骤Ⅱ中加入的试剂可以是__________(填序号)。
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤Ⅱ设计过滤操作的目的是(用化学方程式简要文字表述)__________。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是__________。
(6)Na2S2O3常用作脱氯剂。Na2S2O3溶液与Cl2反应的离子方程式为__________。
【答案】 NaOH溶液 2:1 烧瓶中淡黄色沉淀消失,溶液变澄清 B 分离沉淀,防止S2![]() +2H-===S↓+SO2↑+H2O产生干扰 先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2S2O3混合溶液 S2
+2H-===S↓+SO2↑+H2O产生干扰 先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2S2O3混合溶液 S2![]() +4Cl2+5H2O===10H-+
+4Cl2+5H2O===10H-+![]() +8Cl-
+8Cl-
【解析】(1)根据实验流程分析可知,实验最后有二氧化硫或硫化氢等尾气,会污染空气,要用氢氧化钠溶液吸收,所以E中的试剂是NaOH溶液,故答案为:NaOH溶液;
(2)根据反应Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)、2H2S(aq)+SO2(g)═3S(s)+2H2O(l)、S(s)+Na2SO3(aq)![]() Na2S2O3(aq)可知,Na2S和Na2SO3反应的总方程式为2Na2S+3SO2+Na2SO3=3Na2S2O3,所以Na2S和Na2SO3物质的量之比为2:1,故答案为:2:1;
Na2S2O3(aq)可知,Na2S和Na2SO3反应的总方程式为2Na2S+3SO2+Na2SO3=3Na2S2O3,所以Na2S和Na2SO3物质的量之比为2:1,故答案为:2:1;
(3)根据题中反应原理可知,反应的最后一步是硫与亚硫酸钠反应,反应达到终点时,应是硫与亚硫酸钠恰好完全反应,此时的现象是烧瓶中淡黄色沉淀消失,溶液变澄清,故答案为:烧瓶中淡黄色沉淀消失,溶液变澄清;
(4)检验产品中是否含有Na2SO3和Na2SO4,由于BaS2O3易溶于水,所以可以向样品的溶液中加入氯化钡,若有沉淀,则有Na2SO3或Na2SO4,再将沉淀过滤、洗涤后,向沉淀中加入稀盐酸,看沉淀能否溶解,若沉淀未完全溶解,并有刺激性气味的气体产生,则说明既有Na2SO3又有Na2SO4;
①根据上面的分析可知,步骤II中加入的试剂可以是稀盐酸,故选B;
②步骤II设计过滤操作的目的是分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察,故答案为:分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察;
(5)用Na2S和Na2CO3混合溶液代替Na2S和Na2SO3混合溶液可以减小溶液中的硫酸钠的产生,所以为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行改进,可以先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液,故答案为:先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液;
(6)Na2S2O3溶液与Cl2发生氧化还原反应,生成硫酸根和氯离子,反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+。

【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是__________。
(2)调节反应A的pH范围为__________,可以选择的试剂是__________(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________。
(4)已知滤液中含有碳酸氢纳,写出生成碱式碳酸铜的离子方程式:__________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________。
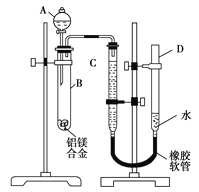
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项 | ①中试剂 | ①中现象 | 解释 |
|
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 | |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 | |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 | |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
A. A B. B C. C D. D