题目内容
【题目】下列反应的离于方程式书写正确的是
A. 向沸水中滴入FeCl3饱和溶液:Fe3+ +3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 向NaOH 溶液中通入过量二氧化硫:OH-+SO2=HSO3-
C. 将一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑
D. 向Fe(NO3)3溶液中加入过量HI溶液:2Fe3++2I-=2Fe2++I2
【答案】B
【解析】A. 向沸水中滴入FeCl3饱和溶液生成氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,A错误;B. 向NaOH溶液中通入过量二氧化硫生成亚硫酸氢钠:OH-+SO2=HSO3-,B正确;C. 将一小块钠投入水中生成氢氧化钠和氢气:2Na+2H2O=2Na++2OH-+H2↑,C错误;D. 向Fe(NO3)3溶液中加入过量HI溶液,碘离子首先还原硝酸根离子,D错误,答案选B。
Fe(OH)3(胶体)+3H+,A错误;B. 向NaOH溶液中通入过量二氧化硫生成亚硫酸氢钠:OH-+SO2=HSO3-,B正确;C. 将一小块钠投入水中生成氢氧化钠和氢气:2Na+2H2O=2Na++2OH-+H2↑,C错误;D. 向Fe(NO3)3溶液中加入过量HI溶液,碘离子首先还原硝酸根离子,D错误,答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
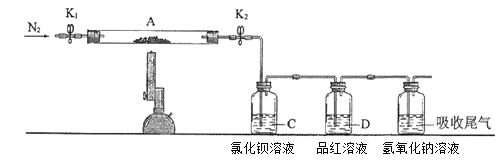
小学生10分钟应用题系列答案【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是__________。
(2)调节反应A的pH范围为__________,可以选择的试剂是__________(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________。
(4)已知滤液中含有碳酸氢纳,写出生成碱式碳酸铜的离子方程式:__________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________。
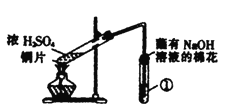
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项 | ①中试剂 | ①中现象 | 解释 |
|
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 | |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 | |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 | |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
A. A B. B C. C D. D