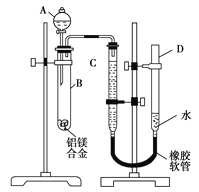
题目内容
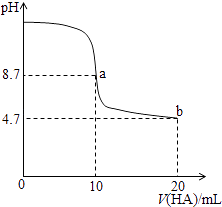
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
【答案】D
【解析】在氢氧化钠溶液中通入一定量的二氧化碳后,溶液中溶质的组成可能是NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3四种情况,没有产生二氧化碳时的反应可能为:OH-+H+=H2O和CO32-+H+=HCO3-,产生二氧化碳的反应为:HCO3-+H+=H2O+CO2↑;由图中HCl的用量与产生二氧化碳气体体积的关系可知,甲溶液中溶质只能为Na2CO3和NaHCO3,乙溶液的溶质为NaOH和Na2CO3;则A.根据图象可知,当V(HCl)=50mL时,得到的产物为NaCl,由原子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.1mol/L×0.05L=0.005mol,则原氢氧化钠溶液的浓度为:c(NaOH)=0.005mol÷0.01L=0.5mol/L,A正确;B.根据以上分析可知当0<V(HCl)<10mL时,甲溶液中没有产生二氧化碳的离子方程式为:H++CO32-=HCO3-,B正确;C.根据以上分析可知乙溶液中含有的溶质是Na2CO3、NaOH,C正确;D.乙溶液中滴加盐酸,产生二氧化碳的阶段为:HCO3-+H+=H2O+CO2↑,根据消耗了10mL盐酸可知,生成二氧化碳的物质的量为:0.1mol/L×0.01L=0.001mol,标况下0.001mol二氧化碳的物质的量为:22.4L/mol×0.001mol=22.4mL,D错误;答案选D。

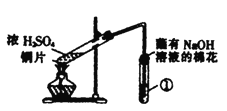
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项 | ①中试剂 | ①中现象 | 解释 |
|
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 | |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 | |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 | |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
A. A B. B C. C D. D