��Ŀ����
����Ŀ���о���ѧϰС�����������й�װ�ý���̽��ʵ�飬�ش�������⡣

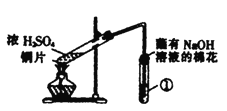
��1��д��A�еķ�Ӧ��ѧ����ʽ_______________________________________________________
��2��ʵ��ʱ������װ��A�з�Һ©��������������Һ����������������ֹͣ������ܵ�ԭ����_________________________________��
��3��װ��B�е���Һ���ֻ��ǣ���ʵ��֤��SO2����___�� ��
��4��ʵ��ⶨװ��C����Һ�ʼ��ԡ���ҺΪʲô�ʼ����أ�����в�ͬ������������ɵ�Na2SO3ˮ�⣻������������ʣ�ࡣ�����ʵ�鷽��֤���������������ѡ�������Լ�����ʵ�飺Na2SO3��Һ����̪��Һ����ˮ��BaCl2��Һ��ϡ����
ʵ�鲽�� | ʵ����� | Ԥ����������� |
_____ | _______________ | _______________ |
��5����һС������װ��D����ʵ�飺��ע������װ��D��ע��v mLʵ�����Ʊ�SO2�Ŀ���������Һ�պ���ɫ��ֹͣʵ�顣��С���ʵ��Ŀ����_________________________________��
���𰸡� Na2SO3������+H2SO4��Ũ���� Na2SO4 + SO2��+ H2O û�д�Һ©�����Ͽڻ��������Һ©���Ͽڻ����ϵİ���û�����Һ©���ϵ�С����ͨ��������������������ͨ ������ I ȡ������Һ���Թ������뼸�η�̪��Ȼ�����������BaCl2��Һ ��Һ�ȱ����Ȼ������������������ɫ��ȥ����˵������ȷ������ɫ������ȥ����˵������ȷ �ⶨʵ���ҿ�����SO2����
�������������������1��A��ŨH2SO4��Na2SO3��Ӧ����SO2�����Ի�ѧ����ʽΪ��Na2SO3���̣�+H2SO4��Ũ���� Na2SO4 + SO2��+ H2O��
��2�����û�д�Һ©�����Ͽڻ��������Һ©���Ͽڻ����ϵİ���û�����Һ©���ϵ�С����ͨ����Ũ������������ʱ����Һ©��Ϊ�ܱ�������Ũ���������С���������������ѹǿ��С���ᵼ��Һ����������������ֹͣ��
��3��װ��B�е���Һ���ֻ��ǣ�SO2��H2S��Ӧ����S������H2O��SO2��SԪ�ػ��ϼ۽��ͣ����Ը�ʵ��֤��SO2���������ԡ�
��4����������ɵ�Na2SO3ˮ��ʹ��Һ�ʼ��ԣ�����������BaCl2��Һ��Na2SO3��BaCl2��Ӧ����BaSO3������Na2SO3��ˮ��ƽ�������ƶ�����Һ��ɫ��ȥ��������������ʣ�ർ����Һ�ʼ��ԣ���������BaCl2��Һ����Һ��Ȼ�ʼ��ԣ���ɫ������ȥ��
��5������Һ�պ���ɫ��ֹͣʵ�飬��ͨ��ע������������ʣ����������������ͨ����ʵ��ɲⶨʵ���ҿ�����SO2������

 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�����Ŀ������ͼ��ʾװ�ý���ʵ�飬���ж�ʵ������Ľ��Ͳ���������
ѡ�� | �����Լ� | �������� | ���� |
|
A | Ʒ����Һ | ��Һ��ɫ | SO2����Ư���� | |
B | Na2SiO3��Һ | ������״���� | ���ԣ�H2SO3>H2SiO3 | |
C | ����KMnO4��Һ | ��ɫ��ȥ | SO2���л�ԭ�� | |
D | Ba(NO3)2��Һ | ���ɰ�ɫ���� | SO32-��Ba2+���ɰ�ɫBaSO3���� |
A. A B. B C. C D. D