题目内容
【题目】向盛有100mL1mol·L-1稀硫酸的烧杯中,缓慢加入铁粉和铜粉的混合物,并用玻璃棒不断地搅拌,下图是溶液中的某种微粒(X) 的物质的量随加入混合物质量变化的关系图。下列说法一定正确的是( )
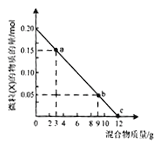
A. 该金属混合物中,铁粉的质量分数约为15.6%
B. a点时,再向烧杯中加入KNO3固体,无明显现象
C. b点时,再向烧杯中滴加0.1mol·L-1的NaOH溶液,立刻产生白色沉淀
D. C点时,再向烧杯中通入Cl20.16mol充分反应,铜粉完全溶解
【答案】D
【解析】已知n(H2SO4)=0.1L×1mol·L-1=0.1mol,则n(H+)=0.2mol,结合图象分析可知,该图象为c(H+)随混合物质量变化的关系图,当混合物质量为12g时,H+完全反应,此时消耗的铁的物质的量为0.1mol,质量为5.6g,所以混合物中铁的质量分数为5.6g/12g×100%=46.7%,所以A错误;B、a点时溶液中还有H+剩余,此时加入KNO3固体,构成的HNO3能够溶解未反应的铜,所以有明显的现象,故B错误;C、b点时溶液中还有H+剩余,此时加入的NaOH首先与剩余的H+反应,然后再与Fe2+反应生成白色沉淀,故C错误;D、c点时溶液中没有H+剩余,生成的n(FeSO4)=0.1mol,此时混合物中n(Cu)=0.1mol,当通入Cl2时,先氧化0.1mol的FeSO4需要n(Cl2)=0.05mol,再氧化0.1mol的Cu需要0.1mol的Cl2,所以当通入Cl20.16mol时铜粉完全溶解,故D正确。本题正确答案为D。

 世纪百通期末金卷系列答案
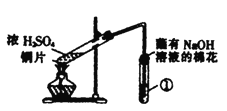
世纪百通期末金卷系列答案【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项 | ①中试剂 | ①中现象 | 解释 |
|
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 | |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 | |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 | |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
A. A B. B C. C D. D