题目内容
【题目】下列有关实验装置或原理正确的是( ) 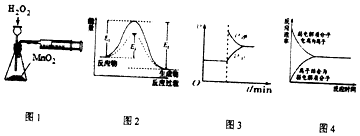
A.利用图1装置可定量测定H2O2的分解速率
B.图2中E1表示使用催化剂后的反应热
C.图3表示在平衡体系FeCl3+3KSCNFe(SCN)3+3KCl的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
D.图4表示弱电解质在水中建立电离平衡的过程
【答案】D
【解析】解:A.充分双氧水不能用长颈漏斗,应该用分液漏斗,否则无法可知加入双氧水的量,且生成的氧气会从长颈漏斗中流出,故A错误;B.图2中E1需要能量较高,说明没有使用催化剂,应该是E2使用催化剂后的反应热,故B错误;
C.反应FeCl3+3KSCNFe(SCN)3+3KCl的实质为铁离子与硫氰根离子的反应,加入KCl不影响平衡,故C错误;
D.弱电解质存在电离平衡,平衡时正逆反应速率相等,图像符合电离特点,故D正确;
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
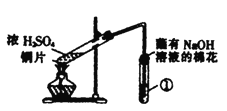
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项 | ①中试剂 | ①中现象 | 解释 |
|
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 | |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 | |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 | |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
A. A B. B C. C D. D