题目内容
14.下列有关金属腐蚀与防护的说法不正确的是( )| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
分析 A、钢铁在溶解性条件下发生吸氧腐蚀;
B、在电解池中,阳极金属易被腐蚀;
C、海轮外壳连接锌块,锌为负极;
D、铁比锡活泼,易被腐蚀.
解答 解:A.弱碱性条件下,钢铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故A正确;
B、地下输油钢管与外加直流电源的正极相连,在该电解池中,阳极金属铁易被腐蚀,故B错误;
C、海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故C正确;
D、锌比铁活泼,当镀锌铁制品的镀层破损时,锌做负极,易被腐蚀,铁被保护,故D正确.
故选B.
点评 本题考查金属的腐蚀与防护,题目难度不大,注意把握金属腐蚀的原理和电化学知识.

练习册系列答案
相关题目
4.一定质量的某有机物与足量金属钠反应要得VAL气体.相同质量的该有机物与足量的NaHCO3浓溶液反应,可得VBL气体.已知在同温同压下VA和VB相同,则该有机物可能是( )
| A. | CH3CH(OH)COOH | B. | HOOC-COOH | ||
| C. | CH3CH2CH2OH | D. |  |
5.有人设计出利用CH4和O2反应,用铂电极在KOH溶液中构成原电池.电池的总反应类似于CH4在O2中燃烧的反应,则下列说法中正确的是( )
| A. | 每消耗l mol CH4可以向外电路提供8 mol e- | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 电池放电时,正极附近的pH不断降低 | |
| D. | 电池放电时,溶液中的OH-向正极移动 |
2.CoCl2•6H2O是一种饲料营养强化剂.以含钴单质废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
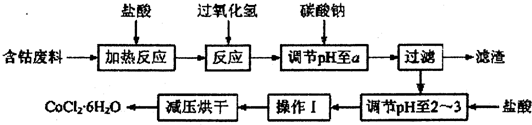
已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,假设杂质不与AgNO3溶液反应,结果保留两位有效数字)

已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,假设杂质不与AgNO3溶液反应,结果保留两位有效数字)
9.下列物质中不属于醇类的是( )
| A. | C3H7OH | B. | 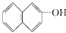 | C. | CH2OHCHOHCH2OH | D. | 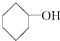 |
6.下列材料都具有一定的特殊性能,其中是由长周期的主族元素和副族元素形成的是( )
| A. | 透明陶瓷材料硒化锌 | B. | SO2和O2反应的催化剂五氧化二钒 | ||
| C. | 半导体材料砷化镓 | D. | 吸氢材料镧镍合金 |
3.铁是一种应用广泛的金属.下列有关铁的说法错误的是( )
| A. | 铁在氧气中燃烧生成四氧化三铁 | B. | 常温下,铁在浓硫酸中会发生钝化 | ||
| C. | 铁与盐酸反应生成氯化铁与氢气 | D. | 铁是一种银白色金属 |
4.下列有关物质的性质或应用的说法正确的是( )
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 | |
| D. | 辛烷、己烯和苯在工业上都可直接通过石油分馏得到 |
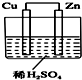 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )