题目内容
5.有人设计出利用CH4和O2反应,用铂电极在KOH溶液中构成原电池.电池的总反应类似于CH4在O2中燃烧的反应,则下列说法中正确的是( )| A. | 每消耗l mol CH4可以向外电路提供8 mol e- | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 电池放电时,正极附近的pH不断降低 | |
| D. | 电池放电时,溶液中的OH-向正极移动 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动.
解答 解:A、通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,每消耗1molCH4可以向外电路提供8mole-;故A正确;
B、通入CH4的电极为负极失电子反应氧化反应,电极反应为:CH4+10OH--8e-=CO32-+7H2O,故B正确;
C、通入氧气的一极为原电池的正极,得到电子发生还原反应:O2+2H2O+4e-=4OH-,所以正极附近的pH不断升高,故C错误;
D、电池反应时阳离子向正极移动,阴离子向负极移动,所以OH-向负极移动,故D错误;
故选AB.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
15.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为同位素;R在元素周期表中的位置是第三周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(填元素符号),下列事实能证明这一结论的是bc.(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4 c.Y与R形成的化合物中Y呈正价.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(填元素符号),下列事实能证明这一结论的是bc.(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4 c.Y与R形成的化合物中Y呈正价.
16.常温常压下,50mL三种气态烃按任意比例混合,与足量氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100mL,则三种烃可能是( )
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | C. | CH4 C2H6 C3H8 | D. | C2H2 C2H6 C3H6 |
13.下列化学用语中,正确的是( )
| A. | 用电子式表示溴化氢的形成过程为: | |
| B. | 海水中Br-的电子式为: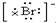 | |
| C. | 海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl | |
| D. | 氯离子的结构示意图为: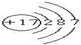 |
10.取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
| A. | 丙烷与氯气在光照的作用下的反应 | B. | 乙烯与溴的四氯化溶液的反应 | ||
| C. | 乙烯与水的反应 | D. | 乙烯自身生成聚乙烯的反应 |
14.下列有关金属腐蚀与防护的说法不正确的是( )
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
15.用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰来制备A12(SO4)3.18H2O.,工艺流程如下(部分操作和条件略):
Ⅰ、向铝灰中加入过量稀H2SO4,过滤:
Ⅱ、向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ、加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ、加入MnSO4至紫红色消失,过滤;
Ⅴ、浓缩、结晶、分离,得到产品.
(1)铝在元素周期表中的位置第三周期ⅢA族;H2SO4溶解Al2O3的离子方程式是:Al2O3+6H+=2Al3++3H2O.
(2)写出Ⅱ中加入过量KMnO4溶液发生的离子方程式:5Fe2++8H++MnO4-=Mn2++5Fe3++4H2O.
(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:将Fe2+氧化为Fe3+,调节pH值使铁元素完全沉淀.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(5)在该实验条件下Ksp[Fe(OH)3]=4.0×10-38,当溶液的pH=3时,溶液中c(Fe3+)=4.0×10-5 mol/L.
Ⅰ、向铝灰中加入过量稀H2SO4,过滤:
Ⅱ、向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ、加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ、加入MnSO4至紫红色消失,过滤;
Ⅴ、浓缩、结晶、分离,得到产品.
(1)铝在元素周期表中的位置第三周期ⅢA族;H2SO4溶解Al2O3的离子方程式是:Al2O3+6H+=2Al3++3H2O.
(2)写出Ⅱ中加入过量KMnO4溶液发生的离子方程式:5Fe2++8H++MnO4-=Mn2++5Fe3++4H2O.
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:将Fe2+氧化为Fe3+,调节pH值使铁元素完全沉淀.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(5)在该实验条件下Ksp[Fe(OH)3]=4.0×10-38,当溶液的pH=3时,溶液中c(Fe3+)=4.0×10-5 mol/L.





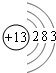 ,它的单质能(填能或不能)与氢氧化钠溶液反应.
,它的单质能(填能或不能)与氢氧化钠溶液反应.