题目内容
4.一定质量的某有机物与足量金属钠反应要得VAL气体.相同质量的该有机物与足量的NaHCO3浓溶液反应,可得VBL气体.已知在同温同压下VA和VB相同,则该有机物可能是( )| A. | CH3CH(OH)COOH | B. | HOOC-COOH | ||
| C. | CH3CH2CH2OH | D. |  |
分析 该物质能和钠反应生成氢气,说明存在羟基、羧基中的一种、两种,能和碳酸钠反应生成气体,说明含有羧基,生成的氢气和二氧化碳相同条件下体积相同,即生成的氢气和二氧化碳物质的量相等,则溶液中羟基和羧基个数相等,据此分析解答.
解答 解:该物质能和钠反应生成氢气,说明存在羟基、羧基中的一种、两种,能和碳酸钠反应生成气体,说明含有羧基,化学反应中,羟基、羧基与氢气的个数比为2:1,羧基与二氧化碳个数之比为1:1,生成的氢气和二氧化碳相同条件下体积相同,即生成的氢气和二氧化碳物质的量相等,则溶液中羟基和羧基个数相等,故选A.
点评 本题考查有机物结构式的确定,侧重考查分析计算能力,明确羟基和羧基与氢气、羧基与二氧化碳关系式是解本题关键,题目难度不大.

练习册系列答案
相关题目
15.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为同位素;R在元素周期表中的位置是第三周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(填元素符号),下列事实能证明这一结论的是bc.(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4 c.Y与R形成的化合物中Y呈正价.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(填元素符号),下列事实能证明这一结论的是bc.(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4 c.Y与R形成的化合物中Y呈正价.
12.在一定体积的18mol•L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的体积为( )
| A. | 等于50 mL | B. | 大于50 mL | C. | 等于100 mL | D. | 大于100 mL |
19.某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素原子的核内中子数比核外电子数多( )
| A. | 4 | B. | 12 | C. | 16 | D. | 18 |
16.常温常压下,50mL三种气态烃按任意比例混合,与足量氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100mL,则三种烃可能是( )
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | C. | CH4 C2H6 C3H8 | D. | C2H2 C2H6 C3H6 |
13.下列化学用语中,正确的是( )
| A. | 用电子式表示溴化氢的形成过程为: | |
| B. | 海水中Br-的电子式为: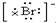 | |
| C. | 海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl | |
| D. | 氯离子的结构示意图为: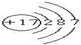 |
14.下列有关金属腐蚀与防护的说法不正确的是( )
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |