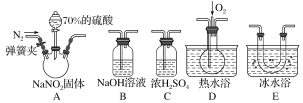
题目内容
【题目】聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( )
A.KClO3作氧化剂,每生成1mol [Fe(OH)SO4]n消耗![]() mol KClO3
mol KClO3
B.绿矾长时间置于空气中易被氧化
C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D.聚合硫酸铁与漂白粉都是纯净物
【答案】D
【解析】
A、1mol [Fe(OH)SO4]n中含n mol Fe3+,则每生成1mol [Fe(OH)SO4]n转移电子n mol,而KClO3的还原产物为Cl-,则1mol KClO3被还原,需要转移电子6mol,由于在氧化还原反应中得失电子数目相同,故每生成1mol [Fe(OH)SO4]n消耗![]() mol KClO3,A正确;
mol KClO3,A正确;
B、绿矾(FeSO4·7H2O)晶体中含Fe2+,该物质易被空气氧化,B正确;
C、聚合硫酸铁可在水中水解形成氢氧化铁胶体而净水,C正确;
D、聚合硫酸铁[Fe(OH)SO4]n中的“n”值不能确定,故该物质为混合物;漂白粉是氢氧化钙、氯化钙、次氯酸钙的混合物;D错误;
故选D。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是
A. v甲=v丙 B. c乙< c丙 C. a甲 +a乙<1 D. K乙≤K丙