题目内容
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。
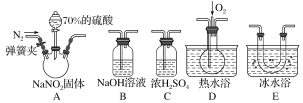
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________。
②装置E的作用是_________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________。
【答案】E D B 防止可能产生的NO被氧气氧化成NO2,造成对A中反应产物检验的干扰 装置D中通入氧气后出现红棕色气体 冷凝,使NO2完全液化 4NO2+O2+4NaOH===4NaNO3+2H2O 2NaNO2+H2SO4===Na2SO4+NO2↑+NO↑+H2O
【解析】
本实验是探究亚硝酸钠与硫酸反应及气体产物的成分。NaNO2中氮元素显+3价,在酸性条件下能发生岐化反应,氮由+3价升高到+4价可产生NO2气体,降到+2价可产生NO气体,可推测NaNO2和H2SO4反应产物中可能含有NO2和NO气体。NO2为红棕色易液化的气体,无色的NO气体极易被O2氧化为NO2。根据NO、NO2的液化温度和性质可知装置D用于检验NO,装置E用于检验并分离NO2,装置B为尾气处理装置,NO2会干扰NO的检验,由此分析解答。
(1) NaNO2中氮元素显+3价,在酸性条件下能发生岐化反应,氮由+3价升高到+4价可产生NO2气体,降到+2价可产生NO气体,可推测NaNO2与H2SO4反应产物中可能含NO和NO2。根据NO、NO2的液化温度和性质可知装置D用于检验NO,装置E用于检验并分离NO2,装置B为尾气处理装置,NO2会干扰NO的检验,所以为了检验装置A中的气体产物,仪器的连接顺序是A、C、E、D、B;
(2)由于NO极易被空气中的氧气氧化为NO2,所以先通入一段时间氮气,排出装置中的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰;
(3)①利用装置D检验NO,根据2NO+O2=2NO2可知,开始时装置D中无色,通入氧气后出现红棕色气体即可证明NO的存在;
②装置E的作用是降温冷凝,使NO2完全液化,除去气体中的NO2,避免干扰NO的检验;
(4)因为NO2、O2和水共同作用可以产生HNO3,所以装置B中发生反应的化学方程式为4NO2+O2+4NaOH=4NaNO3+2H2O;
(5)根据上述实验探究可知,NaNO2和H2SO4反应产生NO2、NO。根据元素守恒、化合价升降守恒可写出装置A中发生反应的化学方程式是2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g) ![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2)∶n(CO)分别为2∶1、5∶2时CO的转化率变化情况(如图1所示),则图中表示n(H2)∶n(CO)=2∶1的变化曲线为________(填“曲线a”或“曲线b”),原因是_________________。

(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 2 mol CO、6 mol H2 | a mol CO、b mol H2、c mol CH3OH(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
(5)CO与日常生产生活相关。

①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________
2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________