题目内容
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。

请回答:
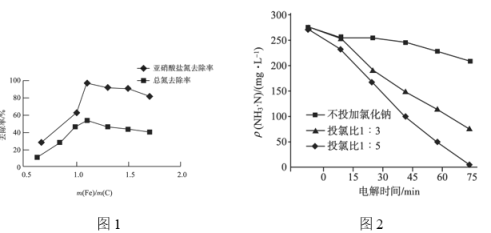
(1)虚线框处宜选择的装置是___(填“甲”或“乙”);实验时应将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是___。
(2)硬质玻璃管中铁和水蒸气反应的化学方程式为___(并用单线桥表示电子转移情况)。取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁,判断结论是否正确并用文字和离子方程式说明理由___。
【答案】乙 铜丝由黑变红 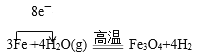 不正确,因为铁过量时:2Fe3++Fe=3Fe2+
不正确,因为铁过量时:2Fe3++Fe=3Fe2+
【解析】
本实验的目的是探究铁、铜及其化合物的性质,其中图中的装置是探究Fe和水蒸气的反应,该反应的产物是Fe3O4和H2;虚线中的装置是CuO和H2反应的场所;根据上述分析答题即可。
(1)图示装置中发生的反应为3Fe+4H2O(g)![]() Fe3O4+4H2,经干燥后H2进入到虚线中的装置,由于该装置中还要发生H2和CuO的反应,故该装置的另外一个作用是收集H2,由于H2的密度比空气小,所以应选用装置乙;将变黑后的铜丝深入到乙中,发生反应H2+CuO
Fe3O4+4H2,经干燥后H2进入到虚线中的装置,由于该装置中还要发生H2和CuO的反应,故该装置的另外一个作用是收集H2,由于H2的密度比空气小,所以应选用装置乙;将变黑后的铜丝深入到乙中,发生反应H2+CuO![]() Cu+H2O,故可看到铜丝由黑变红;
Cu+H2O,故可看到铜丝由黑变红;
(2)硬质玻璃管中的化学反应为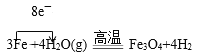 ;用稀盐酸溶解反应后的固体,原本应该有Fe3+,但是加入KSCN后,溶液不变红,说明Fe3+被反应掉了,则最可能的原因是Fe粉过量,和Fe3+发生反应:Fe+2Fe3+=3Fe2+,故题中的结论不正确。
;用稀盐酸溶解反应后的固体,原本应该有Fe3+,但是加入KSCN后,溶液不变红,说明Fe3+被反应掉了,则最可能的原因是Fe粉过量,和Fe3+发生反应:Fe+2Fe3+=3Fe2+,故题中的结论不正确。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结 论 |
A | 向苯酚钠溶液中通入足量CO2溶液变浑浊 | 酸性:H2CO3>C6H5OH>HCO3- |
B | 向KBrO3溶液中通入少量Cl2然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红 | 溶液中存在平衡: 2Fe3++2I- |
D | 向2支均盛有2mL相同浓度银氨溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(Agl)>Ksp(AgCl) |
A.AB.BC.CD.D
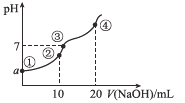
【题目】在温度T1和T2时,分别将0.5molCH4和1.2molNO2充入体积为1L的密闭容器中,发生反应: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A.T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1
B.T2时CH4的平衡转化率为70.0%
C.保持其他条件不变,T1时向平衡体系中再充入0.3molCH4和0.80molH2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.5molCH4和1.2molNO2,与原平衡相比,达新平衡时N2的浓度增大