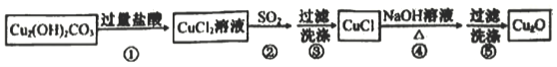题目内容
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe + CuSO4 = FeSO4+ Cu
B. AgNO3+ NaCl= AgCl↓ + NaNO3
C. MnO2 + 4 HCl(浓) ![]() MnCl2+ Cl2↑ + 2 H2O
MnCl2+ Cl2↑ + 2 H2O
D. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
【答案】C
【解析】
A. Fe + CuSO4 = FeSO4+ Cu属于四种基本反应类型中的置换反应,也是氧化还原反应,故A不符合题意;
B. AgNO3+ NaCl= AgCl↓ + NaNO3属于四种基本反应类型中的复分解反应,不属于氧化还原反应,故B不符合题意;
C. MnO2 + 4 HCl(浓) ![]() MnCl2+ Cl2↑ + 2 H2O不属于四种基本反应类型,但属于氧化还原反应,故C符合题意;
MnCl2+ Cl2↑ + 2 H2O不属于四种基本反应类型,但属于氧化还原反应,故C符合题意;
D. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑属于四种基本反应类型中的分解反应,也是氧化还原反应,故D不符合题意;
K2MnO4 + MnO2 + O2↑属于四种基本反应类型中的分解反应,也是氧化还原反应,故D不符合题意;
所以本题答案:C。

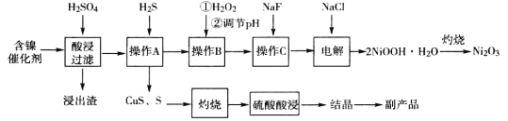
【题目】(加试题)三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,常用于制作重要的电子元件材料和蓄电池材料。某实验室尝试用工业废弃的NiO催化剂(还含有Fe2O3、CaO、CuO、BaO等杂质)为原料生产2NiOOHH2O沉淀,继而制备Ni2O3。实验工艺流程为:
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.6 | 9.7 | 9.2 |
②常温下CaF2难溶于水,微溶于无机酸
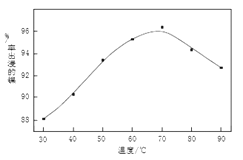
(1)操作B中需调节pH范围为____,使用Na2CO3调节pH过程中发生的反应有___。实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图所示。请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因____。
(2)下列说法正确的是____
A.为提高酸浸效率,可充分搅拌或适当提高硫酸浓度
B.操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀
C.浸出渣的主要成分为CaSO42H2O和BaSO4
D.为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
(3)电解过程中,Cl-在阳极被氧化为ClO-,但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式_____。
(4)操作C加入NaF后如何证明沉淀完全____。
(5)工业上也可通过将草酸镍(NiC2O42H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为____。