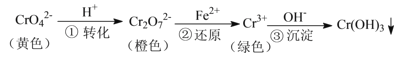题目内容
【题目】向![]() 和
和![]() 的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量
的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量![]() 与加入氢氧化钠溶液的体积
与加入氢氧化钠溶液的体积![]() 关系如图所示.则下列说法正确的是
关系如图所示.则下列说法正确的是

A.ab之间、c两点沉淀物成分相同,d、e两点沉淀物成分相同
B.在反应过程中,各状态点溶液的pH大小顺序是:![]()
C.![]() 段与
段与![]() 段溶液中阴离子的物质的量相等
段溶液中阴离子的物质的量相等
D.在d点,向溶液中逐滴加入盐酸,沉淀量将减少
【答案】A
【解析】
根据图象知,随着氢氧化钠溶液的增加,![]() 、
、![]() 逐渐转化为氢氧化物沉淀,
逐渐转化为氢氧化物沉淀,![]() 、
、![]() ,沉淀的物质的量逐渐增加,
,沉淀的物质的量逐渐增加,
b点时沉淀量最大,说明此点![]() 和
和![]() 完全转化为沉淀,此时溶液中的溶质为NaCl; 继续加入NaOH时,
完全转化为沉淀,此时溶液中的溶质为NaCl; 继续加入NaOH时,![]() 和NaOH反应生成
和NaOH反应生成![]() ,离子反应方程式为
,离子反应方程式为![]() ,沉淀逐渐减少,c点溶液中溶质为
,沉淀逐渐减少,c点溶液中溶质为![]() 和NaCl; d点时,继续滴加NaOH溶液,沉淀的量不再减少,说明此时
和NaCl; d点时,继续滴加NaOH溶液,沉淀的量不再减少,说明此时![]() 完全反应,沉淀为
完全反应,沉淀为![]() ,d点溶液的溶质为
,d点溶液的溶质为![]() 和NaCl; 根据d点知,a点时,
和NaCl; 根据d点知,a点时,![]() 完全转化为沉淀,所以溶液中的溶质为
完全转化为沉淀,所以溶液中的溶质为![]() 和NaCl;e点时,NaOH溶液过量,溶液中的溶质为NaOH、
和NaCl;e点时,NaOH溶液过量,溶液中的溶质为NaOH、![]() 和NaCl,
和NaCl,
A.通过以上分析知,a点后沉淀是![]() 、
、![]() ,c点沉淀是
,c点沉淀是![]() 、
、![]() ,d、e两点沉淀都是
,d、e两点沉淀都是![]() ,故A正确;
,故A正确;
B.e点溶液中的溶质是NaOH、![]() 和NaCl,d点溶质为
和NaCl,d点溶质为![]() 和NaCl,c点溶质成分是
和NaCl,c点溶质成分是![]() 和NaCl,b点溶质成分是NaCl,a点溶质成分是
和NaCl,b点溶质成分是NaCl,a点溶质成分是![]() 和NaCl,所以溶液pH大小顺序是
和NaCl,所以溶液pH大小顺序是![]() ,故B错误;
,故B错误;
C.![]() 段与
段与![]() 段溶液中阴离子种类相同,都是
段溶液中阴离子种类相同,都是![]() 和
和![]() ,但b、c、d三点的NaOH的量未知,所以无法判断阴离子物质的量是否相等,故C错误;
,但b、c、d三点的NaOH的量未知,所以无法判断阴离子物质的量是否相等,故C错误;
D.在d点,溶质是![]() 和NaCl,向溶液中加入少量盐酸,
和NaCl,向溶液中加入少量盐酸,![]() 和盐酸反应生成
和盐酸反应生成![]() 沉淀,故D错误;
沉淀,故D错误;
故选A。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。