题目内容
【题目】工业上常用还原沉淀法处理含铬废水(![]() 和
和![]() ),其流程为:
),其流程为:
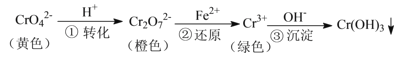
已知:步骤③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有关说法不正确的是
A.步骤①中当![]() 时,说明反应:
时,说明反应:![]() 达到平衡状态
达到平衡状态
B.若向![]() 溶液中加NaOH浓溶液,溶液可由橙色变黄色
溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原![]() 离子,需要
离子,需要![]()
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽![]() 当溶液中
当溶液中![]() 时,可视作该离子沉淀完全
时,可视作该离子沉淀完全![]()
【答案】C
【解析】
该还原沉淀法处理含铬(![]() 和
和![]() )废水的过程是:先加酸使
)废水的过程是:先加酸使![]() 转化成
转化成![]() ,该步是含同价态Cr的不同离子之间的转化;随后,用亚铁盐将
,该步是含同价态Cr的不同离子之间的转化;随后,用亚铁盐将![]() 还原为Cr3+,该步发生的是氧化还原反应;最后调节pH,使Cr3+形成Cr(OH)3沉淀。结合化学平衡、氧化还原反应、溶度积等知识可解各小题。
还原为Cr3+,该步发生的是氧化还原反应;最后调节pH,使Cr3+形成Cr(OH)3沉淀。结合化学平衡、氧化还原反应、溶度积等知识可解各小题。
A. 步骤①中当![]() 时,说明正逆反应速率相等,各组分浓度不再变化,则反应
时,说明正逆反应速率相等,各组分浓度不再变化,则反应![]() 达到平衡状态,故A正确;
达到平衡状态,故A正确;
B. 过程![]() (黄色)
(黄色)![]()
![]() (橙色)的反应为:
(橙色)的反应为:![]() ,则加NaOH浓溶液,平衡逆向移动,
,则加NaOH浓溶液,平衡逆向移动,![]() 会转化成
会转化成![]() ,溶液可由橙色变黄色,故B正确;
,溶液可由橙色变黄色,故B正确;
C. 还原![]() 离子,转移电子为
离子,转移电子为![]() ,Fe元素的化合价由+2升高为+3,则由电子守恒可知,需要
,Fe元素的化合价由+2升高为+3,则由电子守恒可知,需要![]() ,故C错误;
,故C错误;
D. 步骤③中,当将溶液的pH调节至5时,c(OH-)=10-9mol/L,由Ksp可知,![]() ,则可认为废水中的铬元素已经除尽,故D正确;
,则可认为废水中的铬元素已经除尽,故D正确;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气![]() 主要成分为CO、
主要成分为CO、![]() 和
和![]() 在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①
在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①![]() ,②
,②![]() ,③
,③![]() 。
。
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
化学键 |
|
|
|
|
|
| 436 | 343 | 1076 | 465 | 413 |
由此计算![]() ______
______ ![]() 已知
已知![]() ,则
,则![]() ______。
______。
(2)在容积为![]() 的容器中,通入一定量的甲醇发生反应①
的容器中,通入一定量的甲醇发生反应①![]() 时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。
时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。

①在![]() 时段,反应速率
时段,反应速率![]() 为 ______ ;该反应的平衡常数
为 ______ ;该反应的平衡常数![]() 的计算式为 ______ 。
的计算式为 ______ 。
②已知若在恒压条件下进行,平衡时![]() 的转化率
的转化率![]() ______
______ ![]() 填“大于”或“小于”、“等于”
填“大于”或“小于”、“等于”![]() ,判断理由是 ______ 。
,判断理由是 ______ 。
(3)合成![]() 的原理:
的原理:![]() 其他条件相同,实验测得在
其他条件相同,实验测得在![]() 和
和![]() 与
与![]() 和
和![]() 条件下该反应的
条件下该反应的![]() 平衡转化率相同,若
平衡转化率相同,若![]() ,则P1______ P2(填“
,则P1______ P2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。

①写出铜电极表面的电极反应式 ______。
②为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
(5)标准状况下,将![]() 的甲烷完全燃烧生成的
的甲烷完全燃烧生成的![]() 通入到
通入到![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。