题目内容
【题目】用![]() 代替
代替![]() 与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
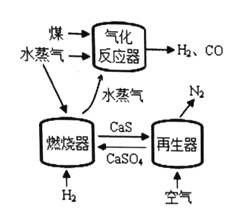
燃烧器中反应①![]() (主反应)
(主反应)
反应②![]() (副反应)
(副反应)
再生器中反应:![]()
(1)气化反应器中发生反应的化学方程式是 ______。
(2)燃烧器中![]() 物质的量分数随温度T、压强p
物质的量分数随温度T、压强p![]() 的变化曲线见图,从图中可以得出三条主要规律:
的变化曲线见图,从图中可以得出三条主要规律:
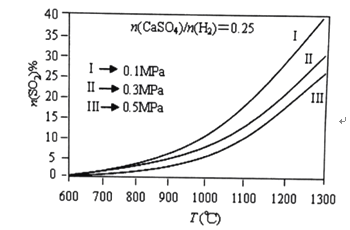
①其他条件不变,温度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由图可知,为减少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)该燃烧技术中可循环的物质除![]() 、CaS外,还有 ______
、CaS外,还有 ______ ![]() 写名称
写名称![]() 。
。
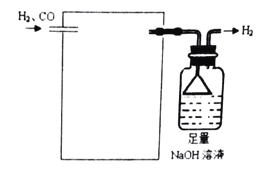
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,完成以下实验装置图:______
中的CO,完成以下实验装置图:______![]() 注:
注:![]() 。
。
(5)CO2在自然界循环时可与![]() 反应,
反应,![]() 是一种难溶物质,其
是一种难溶物质,其![]() 。现将
。现将![]()
![]() 的
的![]() 溶液与一定浓度的
溶液与一定浓度的![]() 溶液等体积混合生成沉淀,计算应加入
溶液等体积混合生成沉淀,计算应加入![]() 溶液的最小浓度为 ______(保留二位有效数字)。
溶液的最小浓度为 ______(保留二位有效数字)。
【答案】![]() 在温度一定时,压强越高,
在温度一定时,压强越高,![]() 含量越低 其它条件不变时,压强越小,温度对
含量越低 其它条件不变时,压强越小,温度对![]() 含量的影响越明显 降低温度,增加压强 水蒸气
含量的影响越明显 降低温度,增加压强 水蒸气 
![]()
【解析】
(1)根据图1的流程图可知,气化反应器中反应物为碳和水,生成物为氢气和一氧化碳,反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据图2可知,在温度一定时,压强越高,![]() 含量越低;其它条件不变时,压强越小,温度对
含量越低;其它条件不变时,压强越小,温度对![]() 含量的影响越明显;根据图2可知,温度越低,压强越大,
含量的影响越明显;根据图2可知,温度越低,压强越大,![]() 含量越小,所以要减少
含量越小,所以要减少![]() 的排放量,可以降低温度,增加压强,故答案为:在温度一定时,压强越高,
的排放量,可以降低温度,增加压强,故答案为:在温度一定时,压强越高,![]() 含量越低;其它条件不变时,压强越小,温度对
含量越低;其它条件不变时,压强越小,温度对![]() 含量的影响越明显;降低温度,增加压强;
含量的影响越明显;降低温度,增加压强;
(3)根据图1的流程图可知,该燃烧技术中可循环的物质除![]() 、CaS外,还有水蒸气,故答案为:水蒸气;
、CaS外,还有水蒸气,故答案为:水蒸气;
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,需要用一个洗气装置,装置中装足量的
中的CO,需要用一个洗气装置,装置中装足量的![]() 溶液,装置图为
溶液,装置图为 ,故答案为:
,故答案为: ;
;
(5)Na2CO3溶液的浓度为![]() ,等体积混合后溶液中
,等体积混合后溶液中![]() ,根据
,根据![]() 可知,
可知,![]() ,原溶液
,原溶液![]() 溶液的最小浓度为混合溶液中
溶液的最小浓度为混合溶液中![]() 的2倍,故原溶液
的2倍,故原溶液![]() 溶液的最小浓度为
溶液的最小浓度为![]() ,故答案为:
,故答案为:![]() 。
。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气![]() 主要成分为CO、
主要成分为CO、![]() 和
和![]() 在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①
在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C=O):①![]() ,②
,②![]() ,③
,③![]() 。
。
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
化学键 |
|
|
|
|
|
| 436 | 343 | 1076 | 465 | 413 |
由此计算![]() ______
______ ![]() 已知
已知![]() ,则
,则![]() ______。
______。
(2)在容积为![]() 的容器中,通入一定量的甲醇发生反应①
的容器中,通入一定量的甲醇发生反应①![]() 时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。
时,体系中各物质浓度随时间变化如图所示(平衡时甲醇的转化率记作a1)。

①在![]() 时段,反应速率
时段,反应速率![]() 为 ______ ;该反应的平衡常数
为 ______ ;该反应的平衡常数![]() 的计算式为 ______ 。
的计算式为 ______ 。
②已知若在恒压条件下进行,平衡时![]() 的转化率
的转化率![]() ______
______ ![]() 填“大于”或“小于”、“等于”
填“大于”或“小于”、“等于”![]() ,判断理由是 ______ 。
,判断理由是 ______ 。
(3)合成![]() 的原理:
的原理:![]() 其他条件相同,实验测得在
其他条件相同,实验测得在![]() 和
和![]() 与
与![]() 和
和![]() 条件下该反应的
条件下该反应的![]() 平衡转化率相同,若
平衡转化率相同,若![]() ,则P1______ P2(填“
,则P1______ P2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(4)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。

①写出铜电极表面的电极反应式 ______。
②为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
(5)标准状况下,将![]() 的甲烷完全燃烧生成的
的甲烷完全燃烧生成的![]() 通入到
通入到![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ______。
【题目】下列根据实验现象得出的结论正确的是![]()
选项 | 实验操作 | 现象 | 结论 |
A | 废 | 得到澄清溶液 | X中一定不含 |
B | 浓度均为 | 产生黑色沉淀 |
|
C |
| 试纸变为蓝色 |
|
D |
| 有机相呈橙色 | 氧化性: |
A.AB.BC.CD.D
【题目】金属钨用途广泛,H2还原WO3可得到钨,其总反应为:WO3+3H2![]() W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
温度(℃) | 25℃~550℃~600℃~700℃ |
主要成分 | WO3 W2O5 WO2 W |
A.1:1:4B.1:1:3C.1:1:2D.1:1:1

