äãá¢áÖàï
Àƒäãá¢À¢À¯Ýð£₤¿ÜáŸÆŠó§¤ãù¥üŠÀÝòú£₤îÏîÏ¢óçá¤ùÅáùÄî½È˜òØöôòÝȘ0.1 molÀÊL1ýïùÃáóàÉؤøÅÇÌåÖÑÁ¡—ó§¤ãȘóðøÅÆÅ¿Äùçñ´í»àñçáòú[¥¤øˆòØöôòÝȘKsp(CaC2O4)=2.4Àê109]
A. ට¨àÉؤý£Ñü¥ÆùÛüÀòëȘå·ùÛçáçÓ⊰äÑàå—ǵ
B. àÉؤøÅ¡¼âŠæÆé´ÑàǵÅÀ¿ÄüçȤc(Na+)> c(C2O42)> c(OH)> c(H+)> c(HC2O4)
C. à¶ÆûpH¥óýãçûàÉؤçápH=9Șå·H2C2O4çáçÖѱ¥ÑçÓâŠó§¤ã°Èò»Ka2=105
D. ü·àÉؤøÅ¥ÆàŠçàäÍ£»CaCl2àÉؤȘçÝ¥ÆàŠçáCaCl2àÉؤé´ÑàǵÆÖ2.4Àê108 molÀÊL1 òÝ¥ÇáÉýºèº°êçÚ
ÀƒÇÞ¯¡À¢C
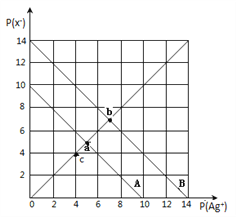
Àƒ§ãö—À¢AÀÂà¶ü·àÉؤøÅý£Ñü¥ÆùÛüÀòëȘîöâÁùÛ§ã°äÑàå—ǵȘç¨ùÛçáçÓ⊰äÑॾÅÀȘ¿òAÇÚöµÈ£BÈÛ0.10mol/LýïùÃáóàÉؤøÅýïùáªâŠæÆñøý§ùÛ§ãàÉؤü奟ÅåȘàÉؤøÅâŠæÆé´ÑàǵÅÀöˆÈ¤c(Na+)ȃc(C2O42-)ȃc(OH-)ȃc(HC2O4-)ȃc(H+)Ș¿òBÇÚöµÈ£CÈÛà¶ÆûpH¥óýãçûàÉؤçápH=9Șc(OH-)=c(HC2O4-)=10-14+9mol/LȘC2O42-+H2O![]() HC2O4-+OH-ȘKh=
HC2O4-+OH-ȘKh=![]() =
=![]() Àê
Àê![]() =
=![]() =
=![]() ȘKa2=10-5Ș¿òCí»àñÈ£DÈÛksp(CaC2O4)=c(Ca2+)c(C2O42-)=2.4Àê10-9Șc(Ca2+)=
ȘKa2=10-5Ș¿òCí»àñÈ£DÈÛksp(CaC2O4)=c(Ca2+)c(C2O42-)=2.4Àê10-9Șc(Ca2+)=![]() =4.8Àê10-8mol/LȘ¿òDÇÚöµÈ£¿òîÀCÀÈ
=4.8Àê10-8mol/LȘ¿òDÇÚöµÈ£¿òîÀCÀÈ

 ç¥îÏਰäêñÇÇÆéîçêñüçêÅÇÞ¯¡
ç¥îÏਰäêñÇÇÆéîçêñüçêÅÇÞ¯¡Àƒäãá¢À¢ÑåùÛîªøÅàÉøòMçáñø§ãùìôòƯüšØ·ùħ½ÅÅîŃ¢ÀÈåÖüÁë˜öôÑàüôȘMçáöÿøòçáê¢é´Ñà(molÀÊL-1)ùÌòÝ¥ð(min)Ýð£₤çáÆÅ¿ÄòçîÕò»ƒï¥«üôÝÚÀÈ
òÝ¥ð ùÛîª | 0 | 5 | 10 | 15 | 20 | 25 |
Âþ(pHȧ2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
·(pHȧ4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
µ(pHȧ4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
¶(pHȧ4Ș¤˜Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
üôêÅùçñ´ý£í»àñçáòú
A. åÖ0À¨20mináÖȘIøÅMçáñø§ãùìôòöˆ0.015 molÀÊL-1ÀÊmin-1
p>B. ùÛîªùÃÅåå§ú¢È˜Mçáñø§ãùìôò姢šC. åÖ0À¨25mináÖȘIIIøÅMçáñø§ã¯ìñøôòÝàIIǵ
D. ÆèÆÖCu2+ÇÌåÖȘIVøÅMçáñø§ãùìôòÝàI¢š