题目内容
15.铁及其化合物在日常生活中很常见(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
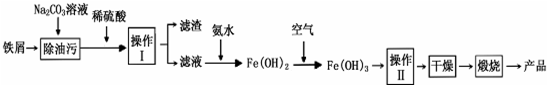
回答下列问题:
①操作Ⅱ所包含的两项主要基本操作是过滤、洗涤. 上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3.
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式:4FeCl2+4H2O+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8HCl.
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4•7H2O)产品中铁元素含量的测定,反应的离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,该滴定过程中否(填“是”或“否”)还需要指示剂.
实验步骤如下:
a.考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加KSCN溶液进行验证.
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c.量取25.00mL待测溶液于锥形瓶中;
d.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
请完成下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250mL容量瓶.
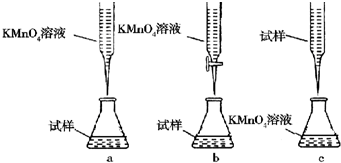
②某同学设计的如图滴定方式,最合理的是b.(夹持部分略去)(填字母序号)
③计算上述样品中FeSO4•7H2O的质量分数为97.5%.
分析 (1)①铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入氨水得到氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁,再经过过滤、洗涤,然后再干燥,灼烧得到氧化铁;
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl;
(2)高锰酸钾溶液具有强氧化性,将Fe2+氧化为Fe3+,滴入最后一滴酸性高锰酸钾溶液,若溶液变红色,说明亚铁离子反应完全,滴定到达终点;
步骤a:Fe2+被氧化为Fe3+,用KSCN溶液检验是否含有Fe3+;
①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;
②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,硫酸亚铁溶液呈酸性,应用酸式滴定管盛放,且向锥形瓶滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大;
③根据离子方程式计算n(Fe2+),由Fe元素守恒可知n(FeSO4•7H2O)=n(Fe2+),再根据m=nM计算m(FeSO4•7H2O),进而计算样品中FeSO4•7H2O的质量分数.
解答 解:(1)①铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入氨水得到氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁,再经过过滤、洗涤,然后再干燥,灼烧得到氧化铁,则:
操作Ⅱ所包含的两项主要基本操作是:过滤、洗涤,上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:过滤、洗涤;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl,反应方程式为:4FeCl2+4H2O+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8HCl,
故答案为:4FeCl2+4H2O+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8HCl;
(2)高锰酸钾溶液具有强氧化性,将Fe2+氧化为Fe3+,自身为还原为Mn2+,反应离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色变浅紫红色,不需要另外加入指示剂,
步骤a,Fe2+被氧化为Fe3+,所以事先取少量绿矾产品溶于水,滴加KSN溶液进行验证,若溶液变红色,说明被氧化,否则未被氧化,
①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;
②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,样品硫酸亚铁溶液呈酸性,应用酸式滴定管盛放,且向锥形瓶滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大,故b最合理;
③n(MnO4-)=0.01000mol/L×0.02L=2×10-4mol,由5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,可知n(Fe2+)=5×2×10-4mol=1×10-3mol,
所以250mL溶液中含有知n(Fe2+)=1×10-3mol×$\frac{250mL}{25mL}$=1×10-2mol,
则m(FeSO4•7H2O)=278g/mol×1×10-2mol=2.78g,
样品中FeSO4•7H2O的质量分数为$\frac{2.78g}{2.850g}$=97.5%,
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;否;a.KSCN;①250mL容量瓶;②b;③97.5%.
点评 本题考查化学工艺流程、物质的分离提纯、氧化还原滴定应用、溶液配制等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,难度中等.

| A. | 一定是金属元素 | |
| B. | 一定是非金属元素 | |
| C. | 可能是金属元素,也可能是非金属元素 | |
| D. | 以上均不正确 |
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化
①已知部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
| 化学键 | N=O | C≡O | C=O | N≡N |
| 键能(kj/mol) | 632 | 1072 | 750 | 946 |
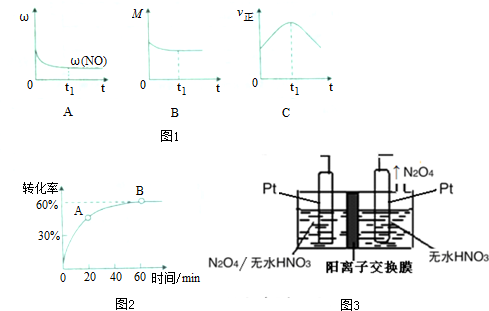
②若上述反应在绝热、恒荣的密闭体系中进行,并在t1时到达平衡状态,则下列示意图不符合题意的是C(填选项序号)(图中1ω、M、?、z分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO2,再合成硫酸,已知:
2SO${\;}_{{\;}_{2}}$(g)+O2(g)$?_{高温}^{催化剂}$2SO2(g)△H=-196.0kj/mol
①在一定温度的密闭容器中,SO2的转化率时间的变化关系如图2所示,则A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2)(填“大于”、“小于”或“等于”)
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同的是BC(填选项序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NO2也可以消除氮氧化物的污染,反应原理为:
NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cb)也可以表示平衡常数(记作Kp),则上述反应的K的表达式为$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$
(4)以N2O4为原料采用电解法可制备新型绿色硝化剂N2O3,实验装置如图3所示,电解池中生成N2O3的电极反应式为N2O4+2HNO3-e-=2N2O3+O2↑+2H+
(5)尾气中氢氧化物(NO和NO2)可用尿素[CO(NH2)3]溶液除去,反应生成对大气无污染的气体,1mol尿素能吸收工业尾气中氢氧化物(假设NO、NO2体积比为1:1)的质量为76g.
①加入AgNO3溶液 ②加入NaOH水溶液 ③加热 ④加入蒸馏水 ⑤加稀硝酸至溶液呈酸性 ⑥加入NaOH醇溶液.
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ③⑥⑤① |
(1)用pH试纸检验溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙红色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生
下列结论正确的是( )
| A. | 肯定含有的离子是③④⑤ | B. | 肯定没有的离子是②⑤ | ||
| C. | 可能含有的离子是①⑥ | D. | 不能确定的离子是③⑥ |
| A. | 符合上述条件的甲共有3种 | |
| B. | 1mol甲最多可以和7molH2发生反应 | |
| C. | 乙中的所有原子一定共平面 | |
| D. | 分别燃烧1mol乙与1mol苯耗氧量相同 |
 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题: