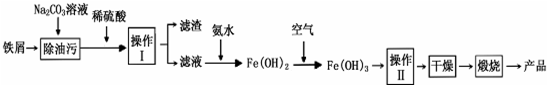
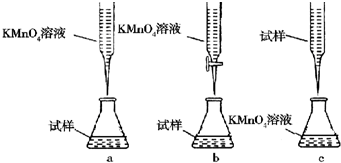
题目内容
6. 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:(l)Z在周期表中的位置第三周期第ⅠA族;W基态原子的价电子排布式3d84s2.
(2)X、Y、Z、Q中,基态原子第一电离能最大的是N(填元素符号).
(3)在XQ-中Q的杂化类型为sp3 X的氧化物(X2O)晶体结构示意图如右,
则 1molX2O晶体含有2mol氢键.
(4)金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
①金属羰基配合物中,微粒间作用力有bc(填字母代号).
a、离子键 b、共价键 c、配位键 d、金属键
②羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于分子晶体(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x=5.
分析 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色,那么Z为钠,X与Y形成的气体能使酚酞溶液变红,故此气体为氨气,则X为氢,Y为氮,X与Q形成18电子的分子,其空间构型为v形,故Q为硫,W的基态原子3d轨道有8种运动状态不同的电子,故W为镍,据此解答各小题即可.
解答 解:元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色,那么Z为钠,X与Y形成的气体能使酚酞溶液变红,故此气体为氨气,则X为氢,Y为氮,X与Q形成18电子的分子,其空间构型为v形,故Q为硫,W的基态原子3d轨道有8种运动状态不同的电子,故W为镍,
综上所述:X为氢,Y为氮,Z为钠,Q为硫,W为镍,
(1)Na在周期表中的位置是第三周期第ⅠA族,Ni的原子序数为28,价电子排布为3d84s2,故答案为:第三周期第ⅠA族;3d84s2;
(2)元素的非金属性越强,其第一电离能越大,H、N、Na、S中,非金属性N的最强,故这些基态原子第一电离能最大的是N,故答案为:N;
(3)H2S分子中共价键键角接近90°,即H-S-H键角接近90°,空间构型为V形,H2S分子中S原子的σ键电子对数为2,孤电子对数=$\frac{1}{2}$(6-1×2)=2,则价层电子对数为4,所以S原子为杂化sp3,在冰晶体中,一个水分子与周围四个水分子形成正四面体结构,一个水分子可以形成四个氢键,而二个水分子共一个氢键,故一个水分子可形成二个氢键,1mol冰晶体中存在2mol氢键,故答案为:sp3;2;
(4)①金属羰基配合物中应含有配位键,羰基中含有共价键,故答案为:b c;
②羰基铁沸点低,应为分子晶体,羰基铁中铁能提供的空轨道数为5,故答案为:分子晶体;5.
点评 本题主要考查的是元素的推断,涉及价电子排布图、杂化方式、冰的结构与氢键等,综合性较强,有一定难度.

| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
| A. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y | |
| C. | W的氢化物熔沸点比Z的氢化物熔沸点低 | |
| D. | Y与R形成的化合物YR的熔点高、硬度大 |
| A. | 加水稀释$\frac{c(O{H}^{-})}{c({H}^{+})}$增大的溶液:K+、Na+、SO42-、AlO2- | |
| B. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| C. | 铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3- | |
| D. | NaHCO3溶液:K+、Na+、SO42-、Al3+ |
| A. | 2 CO(g)+O2(g)═2 CO2(g);△H=-566 KJ•mol-1 | |
| B. | CH4(g)+2 O2(g)═CO2(g)+2 H2O(l);△H=-890 KJ•mol-1 | |
| C. | H2 (g)+F2 (g)→2HF(g),△H=-270kJ•mol-1 | |
| D. | 250℃和1.01×105Pa时,反应4NO2(g)+O2(g)═2N2O5(g);△H=-56.76kJ/mol |
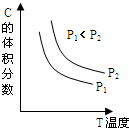 已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )
已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )| A. | 正反应为吸热反应 | |
| B. | 100摄氏度时,当生成cmolC,放出E KJ热量 | |
| C. | a+b<c+d | |
| D. | 降低压强,正、逆反应速率都减小 |
 ;
; ;
;