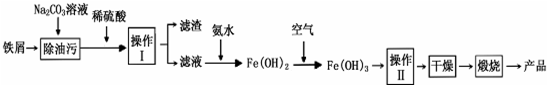
题目内容
3.2014年全国各地都遭遇了“十面埋伏”,二氧化硫、氮氧化物和可吸入颗粒是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化
①已知部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
| 化学键 | N=O | C≡O | C=O | N≡N |
| 键能(kj/mol) | 632 | 1072 | 750 | 946 |
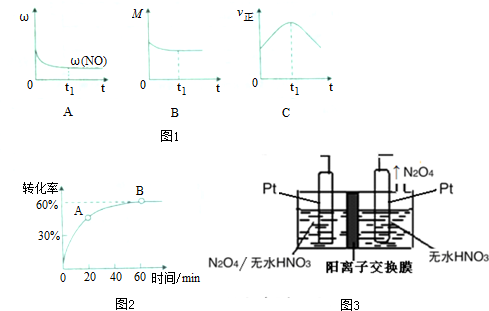
②若上述反应在绝热、恒荣的密闭体系中进行,并在t1时到达平衡状态,则下列示意图不符合题意的是C(填选项序号)(图中1ω、M、?、z分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO2,再合成硫酸,已知:
2SO${\;}_{{\;}_{2}}$(g)+O2(g)$?_{高温}^{催化剂}$2SO2(g)△H=-196.0kj/mol
①在一定温度的密闭容器中,SO2的转化率时间的变化关系如图2所示,则A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2)(填“大于”、“小于”或“等于”)
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同的是BC(填选项序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NO2也可以消除氮氧化物的污染,反应原理为:
NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cb)也可以表示平衡常数(记作Kp),则上述反应的K的表达式为$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$
(4)以N2O4为原料采用电解法可制备新型绿色硝化剂N2O3,实验装置如图3所示,电解池中生成N2O3的电极反应式为N2O4+2HNO3-e-=2N2O3+O2↑+2H+
(5)尾气中氢氧化物(NO和NO2)可用尿素[CO(NH2)3]溶液除去,反应生成对大气无污染的气体,1mol尿素能吸收工业尾气中氢氧化物(假设NO、NO2体积比为1:1)的质量为76g.
分析 (1)①先写出化学方程式2NO+2CO═N2+2CO2,然后根据焓变=反应物的总键能-生成物的总键能计算焓变,再根据化学方程式计算2molNO完全燃烧时放出的热量,标注物质聚集状态写出热化学方程式;
②A.到达平衡后各组分的含量不发生变化;
B.到达平衡后,反应前后气体物质的量变化,气体质量不变,结合$\overline{M}$=$\frac{总质量}{总物质的量}$分析;
C.到达平衡后正、逆速率相等,不再变化;
(2)①图象分析可知A点到B点二氧化硫转化率增大,说明A点未达到平衡状态,此时反应正向进行,但随反应物浓度减小,正反应速率减小;
②再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同,平衡不变,依据改变条件和影响平衡的因素分析判断选项;
(3)依据化学平衡常数表达式的书写方法书写;
(4)由N2O4制取N2O5需要失去电子,所以N2O5在阳极区生成;
(5)根据题目信息写出方程式,建立关系式,然后依据关系式进行计算.
解答 解:(1)①反应为2NO+2CO═N2+2CO2,△H=反应物的总键能-生成物的总键能=2×632 kJ•mol-1+2×1072 kJ•mol-1-946 kJ•mol-1-4×750 kJ•mol-1=-538kJ•mol-1,N2H4反应的热化学方程式为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-538kJ•mol-1,
故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-538kJ•mol-1;
②A.NO的质量分数为定值,t1时刻处于平衡状态,故A正确,
B.该反应正反应为放热反应,随反应进行温度升高,平衡逆向进行,反应前后气体物质的量变化,气体质量不变,平均摩尔质量不变说明达到平衡状态,故B正确,
C、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故C错误;
故答案为:C.
(2)①一定温度的密闭容器中,分析SO2的转化率时间的变化可知A点到B点二氧化硫转化率增大,说明A点未达到平衡状态,此时反应正向进行,随反应进行浓度减小,反应速率减小,A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2),
故答案为:<;
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同,分析选项可知
A.在其他条件不变时,减少容器的容积,压强增大,平衡正向进行,体积减小氧气浓度增大,故A错误;
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2,为保持压强不变,体积增大,最后达到相同平衡状态,氧气浓度不变,故B正确;
C.保持温度和容器体积不变,温度不变平衡常数不变,K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,再充入SO2和SO3,使之浓度扩大为原来的两倍,平衡常数不变,氧气浓度不变,故C正确;
故答案为:BC.
(3)NO(g)+NO(g)+2NH3(g)?2N2(g)+3H2O(g)
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cb)也可以表示平衡常数(记作Kp),则上述反应的K的表达式为:
KP=$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$,
故答案为:$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$;
(4)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-e-=2N2O3+O2↑+2H+,
故答案为:N2O4+2HNO3-e-=2N2O3+O2↑+2H+;
(5)由题目信息可知,NO、NO2二者混合物与水反应生成亚硝酸,反应方程式为NO+NO2+H2O=2HNO2;亚硝酸再与尿素反应生成CO2和N2,反应方程式为CO (NH2)2+2HNO2=CO2+2N2+3H2O.
NO+NO2 ~2HNO2 ~CO(NH2)2
(30+46)g 1mol
1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为76g,
故答案为:76;
点评 本题主要考查了热化学方程式书写,电极反应,化学平衡移动、化学平衡常数计算分析判断等,难度不大,培养了学生分析问题的能力.

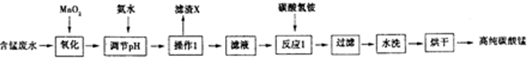
(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.
| A. | 使酚酞变红色的溶液:NH4+、Al3+、NO3-、CO32- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、NO3- | |
| D. | 由水电离出的c(H+)=10-12mol•L-1的溶液:Na+、K+、NO3-、ClO- |
| A. | NH3分子的结构式: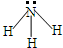 | |
| B. | NH4Cl的电子式: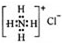 | |
| C. | 原子核内有10个中子的氧原子:818O | |
| D. | Cl-离子的结构示意图: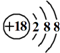 |
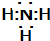 ;
; ;
;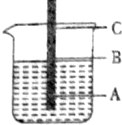 一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问:
一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问: