题目内容
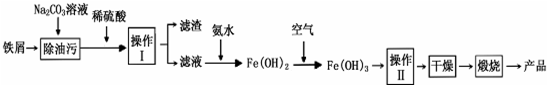
4.某化学小组在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如.
回答下列问题:
(1)实验室进行操作I用到的玻璃仪器有烧杯、漏斗、玻璃棒,操作Ⅱ一系列操作包括蒸发浓缩、冷却结晶、过滤.
(2)写出由CaSO4、NH3、CO2制备(NH4)2SO4的化学方程式:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4.
(3)X物质为NH3(填化学式,下同),Y物质为CO2.
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后称量固体的质量为16.3l g.为避免引起误差,检验氯化钡溶液是否过量的操作为静置后向上层清液再滴加氯化钡溶液,若没有沉淀生成,说明氯化钡溶液过量,反之,氯化钡溶液不足,所制得硫酸铵的纯度为92.4%.
(5)图1装置能用于实验室制氨气的是乙丙丁(填序号).
选择氨气的制取装置后,再用装置图2收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接d,e接g,f接c,b接h.
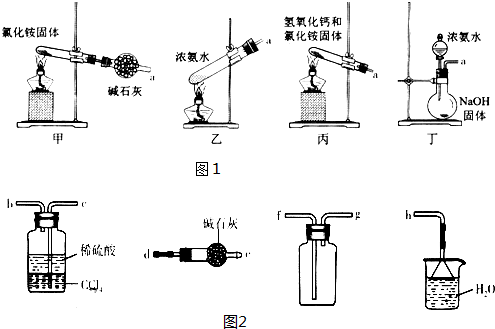
上述装置中CCl4的作用是防倒吸.
分析 在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,由于碱性条件下有利于二氧化碳的吸收,将二氧化碳转化为碳酸根离子,进而得到CaCO3沉淀,故CaSO4溶液先通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,经过过滤分离得到CaCO3与滤液,再煅烧CaCO3生成生石灰与二氧化碳,滤液中含有硫酸铵,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铵晶体.
(1)操作I是过滤,操作Ⅱ从溶液中获得晶体;
(2)CaSO4、NH3、CO2反应生成CaCO3、(NH4)2SO4;
(3)由上述分析,可知X为氨气、Y为二氧化碳;
(4)反应得到16.3l g固体为BaSO4,根据硫酸根守恒计算n[(NH4)2SO4],再根据m=nM计算m[、(NH4)2SO4],进而计算所制得硫酸铵的纯度;
向溶液中滴加过量的氯化钡溶液,目的是使硫酸根离子完全沉淀,静置后向上层清液再滴加氯化钡溶液,根据是否有沉淀生成,可以检验氯化钡是否已过量;
(5)甲中直接加热NH4Cl生成 NH3和HCl,在试管口附近又生成了NH4Cl;乙中加热浓氨水促进NH3的挥发,可制取NH3;丙中加热氢氧化钙和氯化铵固体,发生复分解反应生成NH3;丁中浓氨水滴加到NaOH固体中,可挥发出NH3;
因为收集干燥的NH3,用碱石灰干燥NH3,用向下排空气法收集NH3,通入稀硫酸,制取硫酸铵,后面连接h,进行尾气处理;把NH3直接通入稀硫酸中会发生倒吸,而NH3难溶于CCl4,所以CCl4的作用是防倒吸.
解答 解:在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,由于碱性条件下有利于二氧化碳的吸收,将二氧化碳转化为碳酸根离子,进而得到CaCO3沉淀,故CaSO4溶液先通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,经过过滤分离得到CaCO3与滤液,再煅烧CaCO3生成生石灰与二氧化碳,滤液中含有硫酸铵,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铵晶体.
(1)操作I是过滤,用到的玻璃仪器有烧杯、漏斗、玻璃棒,操作Ⅱ从溶液中获得硫酸铵晶体,硫酸铵的溶解度随温度的降低而减小,所以蒸发浓缩后进行冷却结晶,
故答案为:漏斗、玻璃棒;冷却结晶;
(2)CaSO4、NH3、CO2反应生成CaCO3、(NH4)2SO4,反应方程式为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4;
(3)由上述分析,可知X为氨气、Y为二氧化碳,故答案为:NH3;CO2;
(4)向溶液中滴加过量的氯化钡溶液,目的是使硫酸根离子完全沉淀,静置后向上层清液再滴加氯化钡溶液,若没有沉淀生成,说明氯化钡溶液过量,反之,氯化钡溶液不足,
反应得到16.3l g固体为BaSO4,根据硫酸根守恒:n[(NH4)2SO4]=n(BaSO4)=$\frac{16.31g}{233g/mol}$=0.07mol,则m((NH4)2SO4)=0.07mol×132g/mol=9.24g,硫酸铵的纯度=$\frac{9.24g}{10.0g}$×100%=92.4%;
故答案为:静置后向上层清液再滴加氯化钡溶液,若没有沉淀生成,说明氯化钡溶液过量,反之,氯化钡溶液不足;92.4%;
(5)甲.直接加热NH4Cl生成 NH3和HCl,在试管口附近NH3和HCl反应又生成了NH4Cl,所以不能用来制取NH3,故甲错误;
乙.氨水中存在平衡关系:NH3+H2O═NH3•H2O═NH4++OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可制取NH3,故乙正确;
丙.加热氢氧化钙和氯化铵固体,发生复分解反应生成NH3,可用于制取NH3,故丙正确;
丁.CaO与H2O反应生成Ca(OH)2,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出,又由于Ca(OH)2是强碱,也促进NH3•H2O的分解及NH3的挥发逸出,能用于制取NH3,故丁正确;
因为要收集干燥的NH3,用碱石灰干燥NH3,所以a后接d、e,用向下排空气法收集NH3,后面连接g、f,通入稀硫酸,制取硫酸铵,后面连接c、b,最后连接h,进行尾气处理;
把NH3直接通入稀硫酸中会发生倒吸,而NH3难溶于CCl4,所以CCl4的作用是防倒吸,
故答案为:乙丙丁;d、e、g、f、c、b、h;防倒吸.
点评 本题考查化学工艺流程、实验方案设计、物质分离提纯、化学计算、氨气制备等,是对基础知识的综合运用,较好的考查学生分析解决问题的能力,难度中等.

| A. | 使酚酞变红色的溶液:NH4+、Al3+、NO3-、CO32- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、NO3- | |
| D. | 由水电离出的c(H+)=10-12mol•L-1的溶液:Na+、K+、NO3-、ClO- |
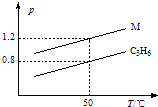 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )| A. | SO2 | B. | CO2 | C. | C3H8 | D. | CO和N2 |
| A. | 质子数相等、电子数和原子数不相等:① | |
| B. | 质子数和电子数相等、原子数不相等:② | |
| C. | 电子数相等、质子数和原子数不相等:③ | |
| D. | 原子数和电子数相等、质子数不相等:④ |
| A. | NH3分子的结构式: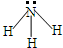 | |
| B. | NH4Cl的电子式: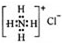 | |
| C. | 原子核内有10个中子的氧原子:818O | |
| D. | Cl-离子的结构示意图: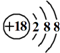 |
| A. | 增加A的量,B的转化率提高 | |
| B. | 压强增大平衡不移动,v(正)、v(逆)均不变 | |
| C. | 增大B的浓度,v(正)>v(逆) | |
| D. | 升高温度,平衡向逆反应方向移动,v(正)减小 |
 ;
;