题目内容
20.证明溴乙烷中溴的存在,下列正确的操作步骤为( )①加入AgNO3溶液 ②加入NaOH水溶液 ③加热 ④加入蒸馏水 ⑤加稀硝酸至溶液呈酸性 ⑥加入NaOH醇溶液.
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ③⑥⑤① |
分析 检验溴乙烷中溴元素,应在碱性条件下加热水解或碱性醇溶液条件下发生消去,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成.
解答 解:检验溴乙烷中溴元素,应在碱性条件下加热水解或碱性醇溶液条件下发生消去,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为②③⑤①或⑥③⑤①,
故选:B.
点评 本题考查溴乙烷的性质,题目难度中等,易错点为卤代烃水解是碱性溶液中进行,加硝酸银时必须先加酸中和碱才能出现溴化银沉淀,注意实验的操作步骤.

练习册系列答案
相关题目
11.下列热化学方程式中的△H能表示对应可燃物质燃烧热的是( )
| A. | 2 CO(g)+O2(g)═2 CO2(g);△H=-566 KJ•mol-1 | |
| B. | CH4(g)+2 O2(g)═CO2(g)+2 H2O(l);△H=-890 KJ•mol-1 | |
| C. | H2 (g)+F2 (g)→2HF(g),△H=-270kJ•mol-1 | |
| D. | 250℃和1.01×105Pa时,反应4NO2(g)+O2(g)═2N2O5(g);△H=-56.76kJ/mol |
8.某工业含锰酸性废水的主要成分为MnSO4,另外还存在Fe2+、Fe3+、Al3+等离子.现以该废水为原料,制备高纯的碳酸锰,工业流程如下:
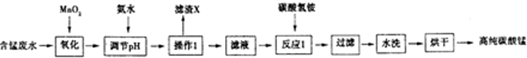
(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
依据表中数据判断,用氨水调节溶液的pH应至5.2.
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.

(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.
5.甲苯和甘油组成的混合物在氧气中完全燃烧,下列说法正确的是( )
| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红色的溶液:NH4+、Al3+、NO3-、CO32- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、NO3- | |
| D. | 由水电离出的c(H+)=10-12mol•L-1的溶液:Na+、K+、NO3-、ClO- |
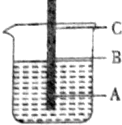 一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问:
一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问: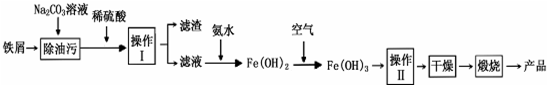
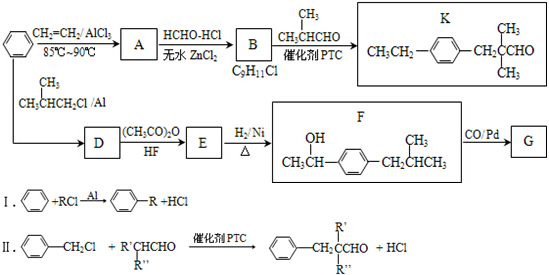
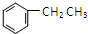 .
.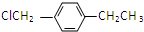 .
.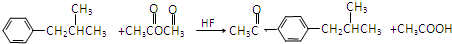 .
.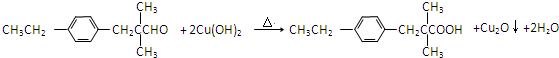
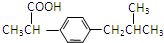 .
.