��Ŀ����
1��Ϊ��СCO2�Ի�����Ӱ�죬�ڳ�������̼����ͬʱ�������ǿ��CO2�������õ��о�����T1��ʱ����9molCO2��12molH2����3L�ܱ������У�������ӦCO2��g��+3H2��g��?CH3OH��g��+H2O��g����H��0��������CH3OH�����ʵ�����ʱ��仯����ͼ����I��ʾ��ƽ��ʱ������ѹǿΪP���ı�ijһ�������½���������Ӧ��CH3OH�����ʵ�����ʱ��仯����ͼ���ߢ���ʾ������˵����ȷ���ǣ�������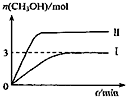
| A�� | ���ߢ��Ӧ�������ı��Ǽ�Сѹǿ | |
| B�� | ��T2��ʱ��������Ӧƽ�ⳣ��Ϊ0.42����T2��T1 | |
| C�� | ��T1��ʱ������ʼʱ�������г���5 mol CO2��5 mol H2��5 mol CH3OH��g���� 5 mol H2O��g�������ƽ��ǰv��������v���棩 | |
| D�� | ��T1��ʱ������ʼʱ�������г���4.5molCO2��6mol H2��ƽ��ʱ������ѹǿP=$\frac{{P}_{1}}{2}$ |
���� A������ӦΪ�������ʵ�����С�ķ�Ӧ����Сѹǿƽ�������ƶ����״������ʵ�����С��
B����ͼ��֪��T1��ʱƽ��ʱ���ɼ״�Ϊ3mol������ƽ��ʱ����ֵ�Ũ�ȣ�����K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$����T1��ʱƽ�ⳣ��������T2��ƽ�ⳣ���Ƚ��ж��¶ȣ�
C..�����ʱŨ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ������Ӧ���У���Qc��K����Ӧ���淴Ӧ���У�������ƽ��ǰv��������v���棩��Դ�С��
D����������Ũ�ȼ��룬���ת���������ƽ��ѹǿ��I��һ�룬ʵ�����൱�ڼ�Сѹǿ��ƽ���������������ķ����ƶ���
��� �⣺A������ӦΪ�������ʵ�����С�ķ�Ӧ����Сѹǿƽ�������ƶ����״������ʵ�����С��ͼ�����ߢ�ƽ��ʱ�״����ʵ��������Ǽ�Сѹǿ������ӦΪ���ȷ�Ӧ��Ӧ�ǽ����¶ȣ���Ӧ���ʼ�����ƽ�������ƶ����״����ʵ�������A����
B����ͼ��֪��T1��ʱƽ��ʱ���ɼ״�Ϊ3mol����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L����3 4 0 0
�仯Ũ�ȣ�mol/L����1 3 1 1
ƽ��Ũ�ȣ�mol/L����2 1 1 1
T1��ʱƽ�ⳣ��K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{1��1}{2��{1}^{3}}$=0.5��T2��ʱƽ�ⳣ��0.42������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ������T2��T1����B����
C��Ũ����Qc=$\frac{\frac{5}{3}��\frac{5}{3}}{\frac{5}{3}����\frac{5}{3}��^{3}}$=0.36��K=0.5����Ӧ������Ӧ���У����ƽ��ǰv��������v���棩����C��ȷ��
D��T1��ʱ������ʼʱ�������ɳ���4.5molC02��6mol H2�����ת������ͬ����ѹǿ��I��һ�룬ʵ���ϣ������I��˵���൱�ڼ�Сѹǿ��ƽ�����淴Ӧ�����ƶ�����ѹǿ����ԭ����һ�룬��D����
��ѡ��C��
���� ���⿼�黯ѧƽ����㡢��������Ի�ѧƽ���Ӱ�졢��ѧƽ�ⳣ��Ӧ�õȣ�ע����������ƽ�ⳣ��Ӧ�ã��Ѷ��еȣ�

| A�� | ���� | B�� | ���� | C�� | ��֬ | D�� | ������ |
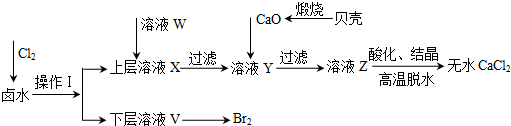
��1��������ʹ�õ��Լ������Ȼ�̼�����õ���Ҫ���������Ƿ�Һ©����
��2��������ҺW��Ŀ���dz�ȥ��Һ�е�SO42-����CaO������ҺY��pH�����Գ�ȥMg2+���ɱ������ݿ�֪�������Ͽ�ѡ���pH���Χ��11.0��pH��12.2���ữ��ҺZʱ��ʹ�õ��Լ�Ϊ���ᣮ
| ��ʼ����ʱ��pH | ������ȫʱ��pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c��OH-��=1.8mol•L-1 |
��1��CO��������������֪��Fe2O3��s��+3C��s���T2Fe ��s��+3CO��g����H1=+489.0kJ•mol-1��
C��s��+CO2��g���T2CO��g����H2=+172.5kJ•mol-1����CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪFe2O3 ��s��+3CO��g��=2Fe��s��+3CO2 ��g����H=-28.5kJ•mol-1��
��2��CO��O2��Ƴ�ȼ�ϵ�أ���KOH��ҺΪ���Һ�����õ�صĸ�����ӦʽΪCO+4OH--2e-=CO32-+2H2O��
��3��CO2��H2����һ������ĺ����ܱ������У��������¶��·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g�� ���CH3OH�����ʵ�����ʱ��ı仯��ͼ1��
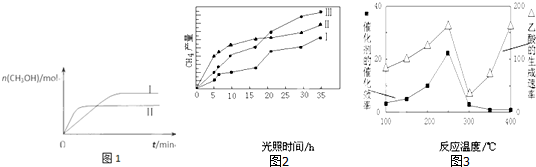
�ٸ÷�Ӧ�ġ�H��0������ڻ�С�ڡ���������I�����Ӧ��ƽ�ⳣ����С��ϵΪK����K���������=������
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⣮
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CO2��3mol H2 | a molCO2��3a molH2�� b molCH3OH��g����b molH2O��g�� |
��4�����ù��ܺ�������ɽ�CO2��H2O��g��ת��ΪCH4��O2�����������ʱ���ڲ�ͬ������I��II��III�������£�CH4���������ʱ��ı仯��ͼ2����0��15Сʱ�ڣ�CH4��ƽ����������I��II��III��С�����˳��ΪII��III��I������ţ���
��5����TiO2/Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᣮ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ3��
�ٵ��¶���300�桫400�淶Χʱ���¶��������������ʵ���ҪӰ�����أ�
��Cu2Al2O4������ϡ���ᣬϡ���ỹԭ����ΪNO��д���йص����ӷ���ʽ3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
 ����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ����1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g����H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ$\frac{c��C{H}_{3}OC{H}_{3}����{c}^{3}��{H}_{2}O��}{{c}^{2}��C{O}_{2}����{c}^{6}��{H}_{2}��}$��
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬��������AD��
A���������ܶȲ��� B����λʱ��������2molCO2��ͬʱ����1mol������
C��v��CO2����v��H2��=1��3 D��������ѹǿ���ֲ���
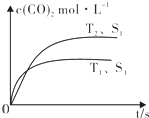
��2������β����������Ҫԭ��Ϊ��2NO��g��+2CO��g��$\stackrel{����}{?}$2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯������ͼ��ʾ���ݴ��жϣ�
�ٸ÷�Ӧ�ġ�H��0��ѡ�����������������
�ڵ��������������һ��ʱ�����������������ѧ��Ӧ���ʣ�
�������ı����S1��S2����ͼ�л���c��CO2����T2��S2�����´ﵽƽ������еı仯���ߣ�
��3����֪��CO��g��+2H2��g��?CH3OH��g����H=-a kJ•mol-1��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
| �¶ȣ��棩 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£�������̶���2L���ܱ������н�1mol CO��2mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
| ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
| ѹǿ�ȣ�P��/Pǰ�� | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
| A�� | 2 0 1 2 0 2 | B�� | 0 2 1 0 1 2 | ||
| C�� | 2 4 3 2 2 6 | D�� | 2 10 6 2 5 12 |
| A�� | Cl2+2FeCl2�T2FeCl3 | B�� | 3I2+6FeCl2�T4FeCl3+2FeI3 | ||
| C�� | Co2O3+6HCl�T2CoCl2+Cl2��+3H2O | D�� | 2Fe3++2I-�T2Fe2++I2 |
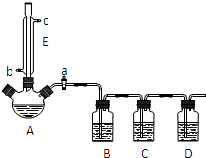 ij��ȤС��ͬѧ���������װ�ã����мг�������������������ȴˮ��û�л��������ü��ȱ����ᡢŨH2SO4���Ҵ������ķ������Ʊ������������������鷴Ӧ�IJ��ָ�����ұ����������ķе�Ϊ213�棬���ѵķе�Ϊ34.6�森
ij��ȤС��ͬѧ���������װ�ã����мг�������������������ȴˮ��û�л��������ü��ȱ����ᡢŨH2SO4���Ҵ������ķ������Ʊ������������������鷴Ӧ�IJ��ָ�����ұ����������ķе�Ϊ213�棬���ѵķе�Ϊ34.6�森