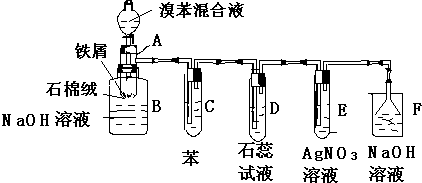
题目内容
16.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe (s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3 (s)+3CO(g)=2Fe(s)+3CO2 (g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
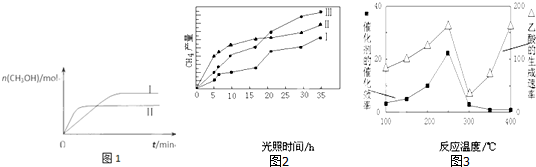
①该反应的△H>0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ<KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a molCO2、3a molH2、 b molCH3OH(g)、b molH2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图2.在0~15小时内,CH4的平均生成速率I、II和III从小到大的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
分析 (1)根据盖斯定律,热化学方程式①-②×3可得:Fe2O3 (s)+3CO(g)=2Fe(s)+3CO2 (g),反应热也进行相应计算;
(2)负极发生氧化反应,正极发生还原反应,CO在负极通入,氧气在正极通入,CO在负极失去电子,碱性条件下生成CO32-与水;
(3)①由图象判断Ⅱ温度高于I,但I甲醇物质的量多,温度高平衡正向移动,平衡常数大,正反应为吸热反应;
②甲中平衡后气体物质的量为4×0.8=3.2mol,气体物质的量变化△n=4-3.2=0.8mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△n=2
CH3OH(g)+H2O(g)△n=2
起始量(mol):1 3
转化量(mol):0.4 1.2 0.4 0.4 0.8
平衡量(mol):0.6 1.8 0.4 0.4
乙中平衡与甲中为等效平衡,为全等等效,即等效转化为反应物量相等,若保持平衡逆向移动,则甲醇的物质的量大于甲中平衡时物质的量,若二氧化碳起始为0时,b的值最大;
(4)在0~15小时内,相同时间内甲烷的产量越大,说明反应速率越快;
(5)①从300℃开始,催化剂对反应基本没有影响,温度升高,生成乙酸速率增大;
②Cu2Al2O4中铜为+1价,与硝酸反应被氧化为+2价,硝酸被还原为NO.
解答 解:(1)已知:①Fe2O3(s)+3C(s)═2Fe (s)+3CO(g)△H1=+489.0kJ•mol-1,
②C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,
根据盖斯定律,热化学方程式①-②×3可得:Fe2O3 (s)+3CO(g)=2Fe(s)+3CO2 (g)△H=-28.5kJ•mol-1,
故答案为:Fe2O3 (s)+3CO(g)=2Fe(s)+3CO2 (g)△H=-28.5kJ•mol-1;
(2)负极发生氧化反应,正极发生还原反应,CO在负极通入,氧气在正极通入,CO在负极失去电子,碱性条件下生成CO32-与水,负极电极反应式为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①由图象判断Ⅱ温度高于I,但I甲醇物质的量多,温度高平衡正向移动,平衡常数大,正反应为吸热反应,则该反应的△H>0,KⅠ<KⅡ,
故答案为:>;<;
②甲中平衡后气体物质的量为4×0.8=3.2mol,气体物质的量变化△n=4-3.2=0.8mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△n=2
CH3OH(g)+H2O(g)△n=2
起始量(mol):1 3
转化量(mol):0.4 1.2 0.4 0.4 0.8
平衡量(mol):0.6 1.8 0.4 0.4
乙中平衡与甲中为等效平衡,为全等等效,即等效转化为反应物量相等,若保持平衡逆向移动,则甲醇的物质的量大于甲中平衡时物质的量,即b>0.4,若二氧化碳起始为0时,b的值最大为1,故0.4<b≤1,
故答案为:0.4<b≤1;
(4)在0~15小时内,相同时间内甲烷的产量越大,说明反应速率越快,由图Ⅱ可知,CH4的平均生成速率顺序为II>III>I,
故答案为:II>III>I;
(5)①从300℃开始,催化剂对反应基本没有影响,温度升高,生成乙酸速率增大,所以①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素,
故答案为:300℃~400℃;
②Cu2Al2O4中铜为+1价,与硝酸反应被氧化为+2价,硝酸被还原为NO,反应的离子方程式为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
点评 本题考查化学平衡计算与影响因素、盖斯定律应用、原电池原理、化学图象问题、氧化还原反应等,题目比较综合,是对学生综合能力的考查,难度中等.

| A. | 溴乙烷$\stackrel{NaOH/水}{→}$乙醇$\stackrel{浓硫酸}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| B. | 溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| C. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{HBr}{→}$溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| D. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 |
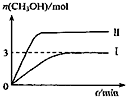
| A. | 曲线Ⅱ对应的条件改变是减小压强 | |
| B. | 若T2℃时,上述反应平衡常数为0.42,则T2<T1 | |
| C. | 在T1℃时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) | |
| D. | 在T1℃时,若起始时向容器中充入4.5molCO2、6mol H2,平衡时容器内压强P=$\frac{{P}_{1}}{2}$ |
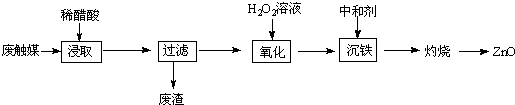
(1)浸取在三口烧瓶中进行,需给三口烧瓶加热并搅拌的目的是提高浸出速率和浸取率;浸出率随着浸取时间先增大后又减小,其原因是开始反应是加热搅拌加快浸出速率,但生成的醋酸锌被活性炭吸附,浸出率减小.
(2)若先将废触媒在马弗炉中通氧气500℃处理一段时间,浸出率会大大提高,其原因是将吸附在活性炭孔内的醋酸锌全部释放出来.
(3)加入H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;沉铁需将溶液pH调整到约为5,最适宜的中和剂是bc(选填序号:a.石灰水 b.ZnO c.Zn.).
(4)高温灼烧时用到的硅酸盐质的仪器有酒精灯、坩埚和泥三角.
(5)某探究学习小组的同学拟利用废电池锌皮(主要成分为Zn,还含有少量的铁)制取氧化锌.如表列出了几种离子生成氢氧化物沉淀的pH:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
| A. | 1mol•L-1的NaCl溶液是指此溶液中含有1mol NaCl | |
| B. | 从1L0.5mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol/L | |
| C. | 25℃时,1mol Cl2的体积约为22.4L | |
| D. | 1mol•L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol/L |

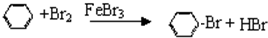 ,反应类型:属于取代反应;
,反应类型:属于取代反应;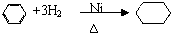 ,反应类型:属于加成反应.
,反应类型:属于加成反应.