题目内容
9.实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下: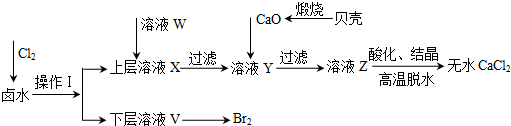
(1)操作Ⅰ使用的试剂是四氯化碳,所用的主要仪器名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择的pH最大范围是11.0≤pH<12.2.酸化溶液Z时,使用的试剂为盐酸.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
分析 实验室以含有Ca2+、Mg2+、Cl-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,应将混合物中的Mg2+、SO42-、Br-等离子除去,根据流程可以看出分别加入氯气将溶液中的Br-氧化溴单质,加入氯化钡除去SO42-,用CaO调节溶液Y的pH,可以除去Mg2+.
(1)单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗;
(2)分析表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;除杂时不能引入新的杂质.
解答 解:(1)氯气具有强氧化性,通入氯气后可以将溶液中的Br-氧化溴单质,因为单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗.由流程图可知单质溴在下层,因此该有机溶剂的密度要比水的大且不溶于水,所以该试剂是CCl4,故答案为:CCl4;分液漏斗;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;由表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,故答案为:除去溶液中的SO42-;11.0≤pH<12.2;盐酸.
点评 本题主要考查常见的基本实验操作、仪器的使用和实验方案设计,综合性强,难度中等,建议学生多重视基础知识的学习,着力提高分析问题、解决问题的能力.

练习册系列答案
相关题目
13.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂.下列反应与Cl2+SO2+2H2O=H2SO4+2HCl相比较,水的作用完全相同的是( )
| A. | 2H2O $\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2Na+2H2O=2NaOH+H2↑ | D. | Cl2+H2O=HCl+HClO |
4.制取1,2-二溴乙烷,下列方案中最合理的是( )
| A. | 溴乙烷$\stackrel{NaOH/水}{→}$乙醇$\stackrel{浓硫酸}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| B. | 溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| C. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{HBr}{→}$溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| D. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 |
14.在372K时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为 0.02mol•L-1.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )
| A. | 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 在2s时体系内压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含有N2O40.25 mol | |
| D. | 平衡时,N2O4的转化率为40% |
1.为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.在T1℃时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如下图曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如下图曲线Ⅱ所示.下列说法正确的是( )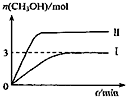

| A. | 曲线Ⅱ对应的条件改变是减小压强 | |
| B. | 若T2℃时,上述反应平衡常数为0.42,则T2<T1 | |
| C. | 在T1℃时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) | |
| D. | 在T1℃时,若起始时向容器中充入4.5molCO2、6mol H2,平衡时容器内压强P=$\frac{{P}_{1}}{2}$ |
19.下列反应属于加成反应的是( )
| A. | CH2=CH2+H-OH$\stackrel{催化剂}{→}$ CH3CH2OH | |
| B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$ 2HCl | |
| C. | CH3CH2Br+KOH$→_{△}^{H_{2}O}$CH3CH2OH+KBr | |
| D. | CH3CH3+2Cl2 $\stackrel{光}{→}$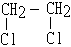 +2HCl +2HCl |
 二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置. ,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.
,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.