题目内容
6. 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是AD.
A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
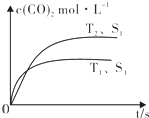
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
①该反应的△H>0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.
若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
分析 (1)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)①T1温度先到达平衡,则温度T1>T2,升高温度二氧化碳的浓度减小,说明升高温度平衡正向移动,则正反应为吸热反应;
②若催化剂的表面积S1>S2,由增大其表面积可提高化学反应速率,故T2、S2条件下到达平衡时间比T2、S1的时间更长,但不影响化学平衡移动,平衡时二氧化碳的浓度不变;
(3)①计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v正、v逆相对大小;
②20min、25min、30min时反应后压强与反应前压强比相同,故20min时到达平衡,根据压强比计算平衡时混合气体总物质的量,再利用差量法计算反应的CO物质的量,进而计算CO转化率.
解答 解:(1)①2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$;
②A.混合气体总质量不变,容器容积不变,容器中密度始终不变,故A错误;
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚,而消耗1mol二甲醚会生成2molCO2,二氧化碳的生成与消耗速率相等,反应到达平衡,故B正确;
C.未指明正逆速率,不能确定是否到达平衡,若分别表示正、逆速率,反应到达平衡,故C错误;
D.反应前后混合气体物质的量发生变化,恒温恒容下,容器内压强变化,但容器内压强保持不变说明得到平衡,故D正确,
故选:BD;
(2)①T1温度先到达平衡,则温度T1>T2,升高温度二氧化碳的浓度减小,说明升高温度平衡正向移动,则正反应为吸热反应,故△H>0,故答案为:>;
②若催化剂的表面积S1>S2,由增大其表面积可提高化学反应速率,故T2、S2条件下到达平衡时间比T2、S1的时间更长,但不影响化学平衡移动,平衡时二氧化碳的浓度不变,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线为 ,
,
故答案为: ;
;
(3)①此时浓度商Qc=$\frac{0.8}{0.4×0.{4}^{2}}$=12.5>K=2.041,反应向逆反应进行,则v正<v逆,故答案为:<;
②20min、25min、30min时反应后压强与反应前压强比相同,故20min时到达平衡,平衡时混合气体总物质的量为(1+2)mol×0.7=2.1mol,则气体物质的量减小3mol-2.1mol=0.9mol,
CO(g)+2H2(g)?CH3OH(g)△n
1 2
0.45mol 0.9mol
故CO转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%.
点评 本题考查化学平衡计算、平衡状态判断、化学平衡影响因素等,需要学生灵活运用基础知识分析解决问题,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡,难度中等.

①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能.
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③④⑨⑥ | D. | 除①②外 |
| A. | 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 在2s时体系内压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含有N2O40.25 mol | |
| D. | 平衡时,N2O4的转化率为40% |
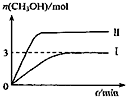
| A. | 曲线Ⅱ对应的条件改变是减小压强 | |
| B. | 若T2℃时,上述反应平衡常数为0.42,则T2<T1 | |
| C. | 在T1℃时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) | |
| D. | 在T1℃时,若起始时向容器中充入4.5molCO2、6mol H2,平衡时容器内压强P=$\frac{{P}_{1}}{2}$ |
| A. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为 453.2g | |
| B. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆) | |
| C. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为40% | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
 二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置. ,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.
,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.