题目内容
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以![]() 与
与![]() 为原料合成化肥尿素的主要反应如下:
为原料合成化肥尿素的主要反应如下:
①![]() ;
;![]()
②![]() ;
;![]()
③![]() ;
;![]()
则a为_________。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:
![]() 。
。
若烟气中![]() 时,通入一定量的空气(
时,通入一定量的空气(![]() 体积分数为
体积分数为![]() ),可利用此法达到最佳脱氮效果。则同温同压下,
),可利用此法达到最佳脱氮效果。则同温同压下,![]() _________。
_________。
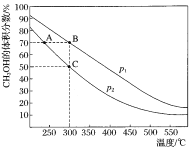
(3)工业固氮反应中,在其他条件相同时,分别测定![]() 的平衡转化率在不同压强(
的平衡转化率在不同压强(![]() 、
、![]() )下随温度变化的曲线,如图所示正确的是_________(填“A”或“B”),
)下随温度变化的曲线,如图所示正确的是_________(填“A”或“B”),![]() 、
、![]() 的大小关系为
的大小关系为![]() _________
_________![]() (填“>”或“<”或“=”),原因是_________。
(填“>”或“<”或“=”),原因是_________。
A.  B.
B. 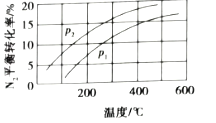
(4)在一定温度下,将![]() 和
和![]() 混合置于
混合置于![]() 密闭容器中发生工业合成氨反应,2分钟达到平衡状态,测得气体总物质的量为
密闭容器中发生工业合成氨反应,2分钟达到平衡状态,测得气体总物质的量为![]() 。
。
①NH3表示该反应的平均速率![]() _________。
_________。
②已知平衡时,容器压强为![]() ,则平衡常数
,则平衡常数![]() _________。(保留2位有效数字)。
_________。(保留2位有效数字)。
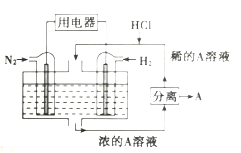
(5)电池在生产生活中有广泛的应用,有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________,A是_________(填化学式)。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________,A是_________(填化学式)。
【答案】+73.0 1:1 A < 该反应是气体分子数减小的反应,温度相同时,加压,平衡正向移动,![]() 的平衡转化率增大
的平衡转化率增大 ![]()
![]()
![]()
![]()
【解析】
(1)根据盖斯定律计算即可;
(2)根据反应![]() 分析得最终需要NO和NO2的体积比为1:1,根据反应2NO+O2=2NO2也可以计算出需要转化NO的体积,以及消耗O2的体积,从而算出需要的空气的体积;
分析得最终需要NO和NO2的体积比为1:1,根据反应2NO+O2=2NO2也可以计算出需要转化NO的体积,以及消耗O2的体积,从而算出需要的空气的体积;
(3)工业固氮的化学方程式为:![]() ,该反应是放热反应,也是气体体积减小的反应,据此分析;
,该反应是放热反应,也是气体体积减小的反应,据此分析;
(4)列出反应的三段式分析即可;
(5)N2和H2反应生成NH3,但溶液中含有HCl,故A为NH4Cl;由于N2作氧化剂,发生还原反应,故左侧电极为正极,其电极反应为![]() 。
。
(1)由题知:2×①+②=③,则②=③-2×①,即△H2=△H3-2△H1=(-87kJ·mol-1)-2×(-80kJ·mol-1)=+73kJ·mol-1;
(2)烟气中![]() ,则假设V(NO)=5L,V(NO2)=1L,根据反应
,则假设V(NO)=5L,V(NO2)=1L,根据反应![]() 可得NO和NO2 的体积比为1:1,由于2NO+O2=2NO2,故消耗2L NO反应生成2L NO2即可,该反应中消耗O2 1L,即需要空气5L,则
可得NO和NO2 的体积比为1:1,由于2NO+O2=2NO2,故消耗2L NO反应生成2L NO2即可,该反应中消耗O2 1L,即需要空气5L,则![]() 5:5=1:1;
5:5=1:1;
(3)工业固氮的化学方程式为:![]() ,该反应是放热反应,则压强不变时,随着温度的升高,平衡逆向移动,则N2的平衡转化率降低,故选A;温度相同时,由于该反应是气体体积减小的反应,增大压强,平衡正向移动,N2的平衡转化率升高,故p1<p2;
,该反应是放热反应,则压强不变时,随着温度的升高,平衡逆向移动,则N2的平衡转化率降低,故选A;温度相同时,由于该反应是气体体积减小的反应,增大压强,平衡正向移动,N2的平衡转化率升高,故p1<p2;
(4)设达到平衡时,N2的转化的量为x mol,则
 ,(1-x)+(3-3x)+2x=2.8,解得x=0.6,即
,(1-x)+(3-3x)+2x=2.8,解得x=0.6,即
 ,
,
①v(NH3)=![]() =0.3mol/(L·min);
=0.3mol/(L·min);
②根据PV=nRT可知,气体的分压和其物质的量成正比,则Kp=![]() =
=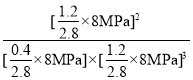 =0.26(MPa)-2;/span>
=0.26(MPa)-2;/span>
(5)N2和H2反应生成NH3,但溶液中含有HCl,故A为NH4Cl;由于N2作氧化剂,发生还原反应,故左侧电极为正极,其电极反应为![]() 。
。