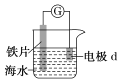
题目内容
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_____。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为_____________。
(4)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(5)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(6)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
【答案】 64 30 g·mol-1 44 g·mol-1 24 ![]() 6.4 mol 0.2 mol
6.4 mol 0.2 mol
【解析】(1).根据标况下的体积计算气体的物质的量,再利用质量和物质的量计算出摩尔质量及相对分子量;(2).根据同温同压下气体的体积之比等于物质的量之比计算;(3).根据同温同体积时,气体的压强之比等于物质的量之比进行计算;(4). 由n=![]() 及氯化物的构成,利用离子的物质的量列式计算;(5).由铁离子的质量求出铁离子的物质的量,根据化学式计算硫酸根离子的物质的量,再除以溶液的体积得硫酸根离子的物质的量浓度;(6). 在配制的溶液中,钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量。
及氯化物的构成,利用离子的物质的量列式计算;(5).由铁离子的质量求出铁离子的物质的量,根据化学式计算硫酸根离子的物质的量,再除以溶液的体积得硫酸根离子的物质的量浓度;(6). 在配制的溶液中,钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量。
(1). 标准状况下,672mL气体的物质的量为n=![]() =0.03mol,气体的摩尔质量为M=1.92g÷0.03mol=64g/mol,该气体的相对分子量为64,故答案为:64;
=0.03mol,气体的摩尔质量为M=1.92g÷0.03mol=64g/mol,该气体的相对分子量为64,故答案为:64;
(2). 在同温同压下,气体的体积之比等于物质的量之比,即CH4和A气体的物质的量之比为15∶8,设二者质量均为a g,则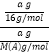 =
=![]() ,解得M(A)=30 g·mol-1,故答案为:30 g·mol-1;
,解得M(A)=30 g·mol-1,故答案为:30 g·mol-1;
(3). 在同温同体积时,气体的压强之比等于物质的量之比,即A和CH4气体的物质的量之比为4∶11,则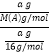 =
=![]() ,解得M(A)=44 g·mol-1,故答案为:44 g·mol-1;
,解得M(A)=44 g·mol-1,故答案为:44 g·mol-1;
(4). 二价金属的氯化物RCl2中含有0.4 mol的Cl-,则RCl2的物质的量为n(RCl2)=![]() =0.2mol,其摩尔质量为M(RCl2)=
=0.2mol,其摩尔质量为M(RCl2)=![]() =95g/mol,则R的相对原子质量为95-35.5×2=24,故答案为:24;
=95g/mol,则R的相对原子质量为95-35.5×2=24,故答案为:24;
(5). V L Fe2(SO4)3溶液中含Fe3+ m g,则n(Fe3+)=![]() =
=![]() mol,根据硫酸铁的化学式可知SO42-的物质的量为n(SO42-)=
mol,根据硫酸铁的化学式可知SO42-的物质的量为n(SO42-)=![]() ×n(Fe3+)=
×n(Fe3+)=![]() ×
×![]() mol,则SO42-的物质的量浓度为c(SO42-)=
mol,则SO42-的物质的量浓度为c(SO42-)=![]() =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(6).在无土栽培中,配制1L含5mol NH4CI、1.6mol KCl、2.4mol K2SO4的某营养液,该营养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol,需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol-6.4mol=0.2mol,故答案为:6.4mol;0.2mol。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案