题目内容
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
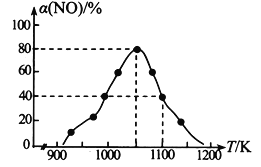
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
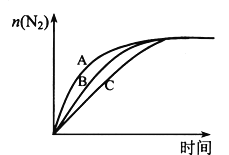
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
【答案】(2a+2b+c)kJmol-1 1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 20% 4 A < 0.25
【解析】
(1)利用盖斯定律解答。
(2)①在1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;达到平衡后,升高温度,平衡左移,NO的转化率降低。恒温恒压下体积分数等于物质的量分数。
②利用化学平衡常数表达式计算。
(3)A反应速率快,先达到平衡,故活化能最小。
(4)①正反应为放热反应,升高温度平衡左移,则正反应速率增大的倍数小于逆反应速率增大的倍数。
②当反应达到平衡时,υ正=υ逆,故![]() =c(N2)c2(CO2)/[c2(NO)c2(CO)]=K。
=c(N2)c2(CO2)/[c2(NO)c2(CO)]=K。
(1)① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;
② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;
③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1;
利用盖斯定律,将①×2+②×2+③可得2SO2(g) + 4NH3H2O(aq) + O2(g) = 2(NH4)2SO4(aq) + 2H2O(l)的△H =(2a+2b+c)kJmol-1,故答案为:(2a+2b+c)kJmol-1。
(2)①在1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;达到平衡后,升高温度,平衡左移,NO的转化率降低。根据反应C (s) + 2NO(g)![]() N2(g) + CO2(g),假设加入1molNO,在1100K时,NO的转化率为40%,则△n(NO)=0.4mol,故n(CO2)=0.2mol,由于反应前后气体的总物质的量不变,故混合气体中CO2的体积分数为
N2(g) + CO2(g),假设加入1molNO,在1100K时,NO的转化率为40%,则△n(NO)=0.4mol,故n(CO2)=0.2mol,由于反应前后气体的总物质的量不变,故混合气体中CO2的体积分数为![]() %=20%,故答案为:1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;20%。
%=20%,故答案为:1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;20%。
②根据反应C (s) + 2NO(g)![]() N2(g) + CO2(g),假设加入1molNO,在1050K时, α(NO)=80%,平衡时n(NO)=0.2mol,n(N2)=0.4mol,n(CO2)=0.4mol,各物质的平衡分压p分(NO)=
N2(g) + CO2(g),假设加入1molNO,在1050K时, α(NO)=80%,平衡时n(NO)=0.2mol,n(N2)=0.4mol,n(CO2)=0.4mol,各物质的平衡分压p分(NO)=![]() Pa,p分(N2)=
Pa,p分(N2)=![]() ×1.1×106Pa,p分(CO2)=
×1.1×106Pa,p分(CO2)=![]() ×1.1×106Pa,故反应的化学平衡常数Kp=
×1.1×106Pa,故反应的化学平衡常数Kp=![]() ×1.1×106Pa×
×1.1×106Pa×![]() ×1.1×106Pa÷(
×1.1×106Pa÷(![]() Pa)2=4,故答案为:4。
Pa)2=4,故答案为:4。
(3)A反应速率快,先达到平衡,故活化能最小,故答案为:A。
(4)①正反应为放热反应,升高温度平衡左移,则正反应速率增大的倍数小于逆反应速率增大的倍数,故k正增大的倍数小于k逆增大的倍数。故答案为:<。
②当反应达到平衡时,υ正=υ逆,故![]() =c(N2)c2(CO2)/c2(NO)c2(CO)=K,根据化学方程式可知,平衡时c (NO)=c(CO)=0.6molL-1,c(N2)=0.2 molL-1,c(CO2)=0.4 molL-1,故
=c(N2)c2(CO2)/c2(NO)c2(CO)=K,根据化学方程式可知,平衡时c (NO)=c(CO)=0.6molL-1,c(N2)=0.2 molL-1,c(CO2)=0.4 molL-1,故![]() = c(N2)c2(CO2)/[c2(NO)c2(CO)]=(0.2×0.42)/(0.62×0.62)=20/81≈0.25,故答案为:0.25。
= c(N2)c2(CO2)/[c2(NO)c2(CO)]=(0.2×0.42)/(0.62×0.62)=20/81≈0.25,故答案为:0.25。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
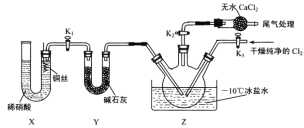
小学生10分钟应用题系列答案【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:①饱和NaClO溶液pH为11;
②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为_________。
②盖紧瓶塞并在暗处反应的原因__________滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)