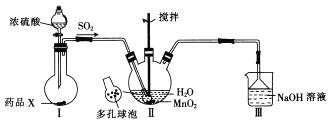
题目内容
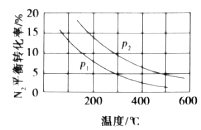
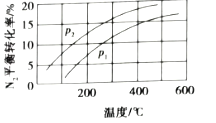
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
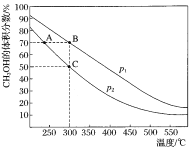
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
【答案】D
【解析】
A.增大压强平衡向正反应方向移动;
B.由图可知,升高温度,平衡逆向移动,该反应的△H<0;
C.平衡常数只与温度有关;
D.设向密闭容器充入了1molCO和2molH2,利用三段法进行数据分析计算.
A.由300℃时,增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,故A错误;
B.图可知,升高温度,CH3OH的体积分数减小,平衡逆向移动,则该反应的△H<0,故B错误;
C.A、B处的温度不同,平衡常数与温度有关,故平衡常数不等,故C错误;
D.设向密闭容器充入了1molCO和2molH2,CO的转化率为x,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始 1 2 0
变化 x 2x x
结束 1-x 2-2x x
在C点时,CH3OH的体积分数=x/(1-x+2-2x+x)=0.5,解得x=0.75,故D正确;
故选D。

 优学名师名题系列答案
优学名师名题系列答案【题目】部分短周期元素的原子半径及主要化合价如下表:
元素 |
|
|
|
|
|
原子半径/ | 0.160 |
| 0.111 | 0.106 | 0.066 |
主要化合价 | +2 | +1 | +2 | +6、-2 | -2 |
下列叙述正确的是( )
A.![]() 一定是金属元素
一定是金属元素
B.原子半径大小:![]()
C.![]() 的简单氢化物的沸点比
的简单氢化物的沸点比![]() 的大
的大
D.![]() 、
、![]() 可能形成阴、阳离子个数比为
可能形成阴、阳离子个数比为![]() 的两种化合物
的两种化合物
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl﹣ CO32﹣ NO3﹣ SO42﹣ SiO32﹣ |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是_____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_______。
(3)将Ⅲ中红棕色气体(标况下)收集一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为_________mol/L(精确到千分位)。
(4)甲同学最终确定原溶液中所含阳离子是___________,阴离子是_______。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为_________________,质量为_______________g。