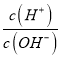题目内容
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
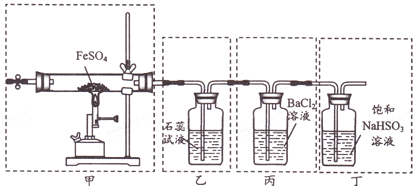
A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
【答案】A
【解析】A.点燃酒精喷灯前应先向装置内通一段时间N2,排除装置中的空气,避免空气中氧气的干扰,A正确;B.装置乙不能检验分解产生的SO2,产物中有SO3对SO2的检验造成干扰,并且SO2只能使石蕊试液变红,B错误;C. SO3极易溶于水,当混合气体经过乙时,SO3会被吸收,所以要想检验SO3,应该把乙和丙的位置互换,C错误;D.装置丁中应该用饱和的Na2SO3溶液,D错误;答案选A.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
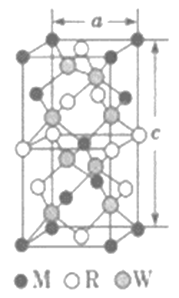
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
【答案】 Li2O O [Ar]3d9或1s22s22p63s23p63d9 高 O2-半径比S2-半径小,Cu2O比Cu2S的晶格能大,所以Cu2O的熔点高 直线形 sp杂化 [N=N=N]- 4 ![]()
【解析】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素;X的单质为固体,常用作电极材料,X只能为Li元素;Z 是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s22s22p4,为O元素;W是主族元素,与Zspan>原子的价电子数相同 ,W为S元素;R 的价层电子排布式为3d64s2,R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素。
(1)锂与氧气反应生成氧化锂,故答案为:Li2O;
(2)同一主族,从上到下,第一电离能逐渐减小,O和S元素相比,第一电离能较大的是O,Cu2+的核外电子排布式为[Ar]3d9,故答案为:O;[Ar]3d9;
(3)氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高,故答案为:高;氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高;
(4)CO2中的C采用sp杂化,VSEPR 模型为直线型;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-,故答案为:直线型; sp;[N=N=N]-;
(5)由面心上Cu与2个S相连,晶胞中每个Cu原子与4个S相连;8个S均在体内,由化学式为CuFeS2,则含晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=![]() =
=![]() gcm-3,故答案为:4;
gcm-3,故答案为:4;![]() 。
。
点睛:本题考查晶胞计算及杂化等,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握物质结构与性质、晶胞结构及计算等为解答该题的关键。本题的难点是晶胞的计算。
【题型】推断题
【结束】
12
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如图所示:
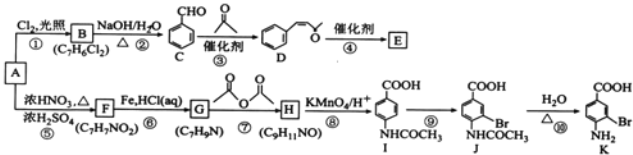
已知: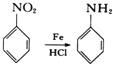 ;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
;有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水。
回答下列问题:
(1)A的名称是_____________。K含有官能团的名称是__________________。
(2)反应⑦的作用是____________________________,⑩的反应类型是____________________________。
(3)写出反应②的化学方程式:____________________________________________________________。
(4)D分子中最多有_____________个原子共平面。E的结构简式为_____________。
(5)1molD与1molH2的加成产物同时满足下列条件的同分异构体有_____________种。
①苯环上只有四种不同化学环境的氢原子;
②能与FeCl3发生显色反应;
③分子中只存在一个环不含其它环状结构。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 _________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO
_________________________(无机试剂及溶剂任选)。合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3