��Ŀ����
����Ŀ�������仯������������������Ӧ�ù㷺��
(1)��֪: ��3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) ��H1=a kJ��mol-1��
��2H2(g)+O2(g)=2H2O(1) ��H2=b kJ��mol-1
��H2O(g)=H2O(l) ��H3=c kJ��mol-1
��3Fe(s)+2O2(g))=Fe3O4(s)��H=_________kJ��mol-1(�ú� a��b��c �Ĵ���ʽ��ʾ)��
(2)���������Ǻϳɰ����Ĵ�������ҵ�ϳɰ���ԭ��ΪN2+3H2![]() 2NH3 ��H<0
2NH3 ��H<0
�ٹ�ҵ���á���ѹ��һ��Ϊ20��50MPa���¶�Ϊ 500�档���á��¶�Ϊ 500�桱��Ŀ����____________��
�ڰ����Ǻϳɵ��ʵ���Ҫԭ�ϡ������£�0.1mol��L-1(NH4)2SO4��Һ������Ũ�ȴ�С����Ϊ___________��
�۳����£���a mL c mol��L-1��ˮ�еμ�b mL c mol��L-1ϡ����ǡ������ҺpH=7(��Һ����仯���Բ���)����NH3��H2O�ĵ��볣��Kb=___��
(3)��ҵ�����Ȼ�ԭ��ұ���������ܱ������У�Ͷ�������� FeO ��ĩ��̿�ۣ���һ���¶��·�����Ӧ��FeO(s)+C(s)Fe(s)+CO(g) ��H>0��
�����ݻ��㶨���������������������Ӧ�ﵽƽ��״̬����___________(�����)
A��FeO ��Ũ�Ȳ��ٸı� B��������Է����������ٸı� C�������ܶȲ��ٸı� D�����۵��������ٸı�
���ڸ��¶��£�������Ӧ�ﵽƽ��ʱc(CO)=a mol��L-1����÷�Ӧ��ƽ�ⳣ��Ϊ________�����¶Ȳ���ʱ�����������������ԭ����4������ﵽ��ƽ��ʱ��c(CO)Ϊ_____________��
���𰸡�a+2b-4c �¶�̫�ͷ�Ӧ���������¶�̫�߲����ڰ����ĺϳ� c(NH4+)��c(SO42-)��c(H+)��c(OH-) ![]() D a a mol��L-1
D a a mol��L-1
��������
(1)���ݸ�˹���ɼ��㣻
(2)����¶ȶ�ƽ���ƶ���Ӱ�졢��Ӧ���ʷ�����𣻽������ˮ��֪ʶ��𣻽�ϵ���غ㡢�����غ�������
(3)��ϻ�ѧƽ��״̬�������жϣ����ƽ�ⳣ��K�ı���ʽ�жϡ�
(1)��֪����3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)��H1=a kJ��mol-1��
��2H2(g)+O2(g)=2H2O(1)��H2=b kJ��mol-1
��H2O(g)=H2O(l)��H3=c kJ��mol-1
��ϸ�˹���ɣ���+2����-4���۵ã�3Fe(s)+2O2(g))=Fe3O4(s)��������H=��H1+2��H2-4��H3=a kJ��mol-1+2b kJ��mol-1-4ckJ��mol-1=(a+2b-4c)kJ��mol-1���ʴ�Ϊ��a+2b-4c��
(2)�ٺϳɰ���Ӧ����H��0���¶�̫�ͷ�Ӧ���������¶�̫�߲����ڰ����ĺϳɣ����¶�Ϊ500�棬�ʴ�Ϊ���¶�̫�ͷ�Ӧ���������¶�̫�߲����ڰ����ĺϳɣ�
��(NH4)2SO4��Һ��NH4+�Ჿ��ˮ�⣺NH4++H2O![]() NH3��H2O+H+����Һ�����ԣ���ˮ�������ģ�����0.1mol��L(NH4)2SO4��Һ������Ũ�ȴ�С����Ϊ��c(NH4+)��c(SO42-)��c(H+)��c(OH-)���ʴ�Ϊ��c(NH4+)��c(SO42-)��c(H+)��c(OH-)��
NH3��H2O+H+����Һ�����ԣ���ˮ�������ģ�����0.1mol��L(NH4)2SO4��Һ������Ũ�ȴ�С����Ϊ��c(NH4+)��c(SO42-)��c(H+)��c(OH-)���ʴ�Ϊ��c(NH4+)��c(SO42-)��c(H+)��c(OH-)��
�۷�Ӧ������Һ��c(NO3-)=![]() ��pH=7��c(H+)=c(OH-)=10-7mol/L����ϵ���غ㣺c(NH4+)+c(H+)=c(OH-)+c(NO3-)��c(NH4+)=c(NO3-)=
��pH=7��c(H+)=c(OH-)=10-7mol/L����ϵ���غ㣺c(NH4+)+c(H+)=c(OH-)+c(NO3-)��c(NH4+)=c(NO3-)=![]() ����������غ�c(NH4+)+c(NH3��H2O)=
����������غ�c(NH4+)+c(NH3��H2O)=![]() �ã�c(NH3��H2O)=
�ã�c(NH3��H2O)=![]() -c(NH4+)=
-c(NH4+)=![]() -
-![]() =
=![]() �����ԣ�NH3��H2O�ĵ��볣��Kb=
�����ԣ�NH3��H2O�ĵ��볣��Kb=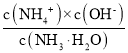 =
=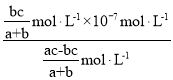 =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)��FeO(s)+C(s)Fe(s)+CO(g) ��H>0��
A��FeO�Ǵ����壬û��Ũ�ȣ�����˵����Ӧ��ƽ�⣬A���������⣻
B����Ӧ������ֻ��CO�����۷�Ӧ�Ƿ�ﵽƽ�⣬������Է������������䣬��������Է����������ٸı䣬����˵����Ӧ��ƽ�⣬B���������⣻
C���ݻ�V�㶨�������=![]() ��֪���ܶ������䣬����������m���䣬��CO���������ٸı䣬˵����Ӧ��ƽ�⣬C�������⣻
��֪���ܶ������䣬����������m���䣬��CO���������ٸı䣬˵����Ӧ��ƽ�⣬C�������⣻
D������Ϊ���������Ӧû��ƽ�⣬�����۵����������ӣ����۵��������ٸı䣬˵����Ӧ�Ѵ�ƽ�⣬D�������⣻
�ʴ�Ϊ��CD��
��ƽ�ⳣ��K=c(CO)=a mol��L-1���¶Ȳ��䣬K���䣬����c(CO)���䣬��c(CO)=a mol��L-1���ʴ�Ϊ��a��a mol��L-1��

 ��У����ϵ�д�
��У����ϵ�д�