��Ŀ����
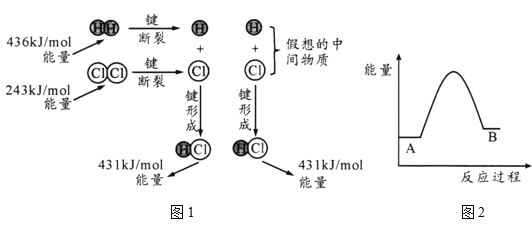
����Ŀ����ҵ����ȡ�������(K2FeO4)��������ȡ�������ƣ�Ȼ���ڵ����£�������������Һ�м���KOH�����;Ϳ�������������ء�ʪ���Ʊ�Na2FeO4����Ҫ��ӦΪ��2Fe(OH)3+3ClO��+4OH����2FeO42��+3Cl��+5H2O���ɷ���Na2FeO4����Ҫ��ӦΪ��2FeSO4+6Na2O2��2Na2FeO4+2Na2SO4+O2���������й�˵������ȷ����(����)
A.ʪ���ɷ��Ʊ��У�����1molNa2FeO4ת�Ƶ�����Ŀ��ͬ
B.��������ڵ����µ��ܽ�ȱȸ������Ƶ��ܽ��С
C.�ɷ��Ʊ�����Ҫ��Ӧ��Na2O2��������
D.K2FeO4����ˮʱ������ɱ�����������ɵ�Fe(OH)3���廹������ˮ�е���������
���𰸡�AC
��������
����������ԭ����ԭ���������ϵ�������ӵ�ת�ơ�����������ԭ����������ֱ������![]() �������������ʡ�
�������������ʡ�
A��ʪ����ÿ����1molNa2FeO4����1molFe(OH)3�μӷ�Ӧ�����ϼ���+3�����ߵ�+6�ۣ�ת�Ƶ���3mol���ɷ���ÿ����1molNa2FeO4����1molFeSO4�μӷ�Ӧ�����ϼ���+2�����ߵ�+6�ۣ�ת�Ƶ���4mol��ͬʱ����0.5mol�������ɣ���ת��1mol���ӣ���������1molNa2FeO4ת�Ƶ�����Ŀ����ͬ����A����
B���ڵ����£�����������ױ�ɹ������������Ը�������ڵ����µ��ܽ�ȱȸ������Ƶ��ܽ��С����B��ȷ��
C����Ӧ��Na2O2��OԪ�صĻ��ϼۼ������ֽ��ͣ���ɷ��Ʊ�����Ҫ��Ӧ��Na2O2�������������ǻ�ԭ������C����
D��K2FeO4����ǿ�����ԣ�������ǿ��������ɱ�����������ɵ�Fe(OH)3������������ԣ��������������D��ȷ��
��ѡAC��

 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�