题目内容
【题目】25℃时,下列说法正确的是
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
C.向盐酸中加入氨水至中性,溶液中c(NH4+)=c(Cl-)
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
【答案】C
【解析】
A.常温下,某物质的溶液pH<7,说明溶液呈酸性,可以是酸的溶液,酸电离使溶液呈酸性;也可以是盐的溶液,盐类水解使溶液呈酸性,盐可以是强酸弱碱盐或弱酸弱碱盐,也可能是强酸的酸式盐,A错误;
B.一定温度下AgCl的溶度积Ksp(AgCl)=c(Ag+)c(Cl-)是定值,c(Ag+)=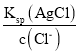 ,同浓度的CaCl2和NaCl溶液中,Cl-浓度前者是后者的2倍,所以AgCl在NaCl溶液中的溶解度更大,B错误;
,同浓度的CaCl2和NaCl溶液中,Cl-浓度前者是后者的2倍,所以AgCl在NaCl溶液中的溶解度更大,B错误;
C.向盐酸中加入氨水,在该溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),由于所得的溶液显中性,则c(H+)=c(OH-),所以c(NH4+)=c(Cl-),C正确;
D.CH3COOH与CH3COONa混合溶液中存在电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),溶液的pH=5.6,则c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),D错误;
故合理选项是D。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】研究表明,在催化剂a(或催化剂b)存在下,CO2和H2能同时发生两个平行反应,反应的热化学方程式如下:
① CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) ΔH1= - 53.7 kJ/mol
CH3OH(g)+ H2O(g) ΔH1= - 53.7 kJ/mol
② CO2(g)+ H2(g)![]() CO(g)+ H2O(g) ΔH2= + 41.2 kJ/mol
CO(g)+ H2O(g) ΔH2= + 41.2 kJ/mol
某实验小组控制CO2和H2初始投料比为1∶2.2。在相同压强下,经过相同反应时间测得的实验数据如下:
实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
1 | 543 | 催化剂a | 12.3 | 42.3 |
2 | 543 | 催化剂b | 10.9 | 72.7 |
3 | 553 | 催化剂a | 15.3 | 39.1 |
4 | 553 | 催化剂b | 12.0 | 71.6 |
(备注)甲醇选择性:转化的CO2中生成甲醇的百分比。
下列说法不正确的是
A. 相同温度下,在该时刻催化剂b对CO2转化成CH3OH有较高的选择性
B. 其他条件不变,升高温度反应①中CO2转化为CH3OH平衡转化率增大
C. 其他条件不变,增大反应体系压强反应②中平衡常数不变
D. 反应①在无催化剂、有催化剂a和有催化剂b三种情况下能量示意图如下: