ЬтФПФкШн
ЁОЬтФПЁПPHBЪЧвЛжжЪїжЌЃЌгаЛњЮяKЪЧвЛжжПЙОЊиЪвЉЮяЃЌЫќУЧЕФКЯГЩТЗЯпШчЯТЃК
вбжЊЃКRЁЂRЁфЁЂRЁхДњБэЬўЛљ
ЂйRCNЁњH2O/H+RCOOH
Ђк
![]() RCOOH+
RCOOH+
Ђл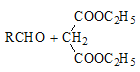
![]()
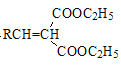 +H2O
+H2O
(1)BЁњCЕФЗДгІРраЭЪЧ_____ЃЎ
(2)аДГівЛЖЈЬѕМўЯТCЁњDЕФЛЏбЇЗНГЬЪН_____ЃКЃЎ
(3)гаЛњЮяМзЕФНсЙЙМђЪНЮЊ_____ЃЎ
(4)аДГіEЁњFЕФЛЏбЇЗНГЬЪН_____ЃЎ
(5)вбжЊ1mol JзюЖргы2mol NaHCO3ЗДгІЃЛKЗжзгНсЙЙжаКЌгавЛИіЮхдЊЛЗгывЛИіСљдЊЛЗЃЎаДГівЛЖЈЬѕМўЯТJЁњKЕФЛЏбЇЗНГЬЪНЃК_____ЃЎ
(6)SЪЧAЕФвЛжжЭЌЗжвьЙЙЬхЃЌЗжзгжаУЛгаЛЗзДНсЙЙЃЌSЕФКЫДХЙВеёЧтЦзгаШ§ИіЗхЃЌЗхУцЛ§жЎБШЮЊ6ЃК3ЃК1ЃЌдђSЕФНсЙЙМђЪНЮЊ(аДГівЛжжМДПЩ)_____ЃЎ
ЁОД№АИЁПМгГЩЗДгІЃЈЛђЛЙдЗДгІЃЉ n![]()
![]()
![]() +(n-1)H2O
+(n-1)H2O ![]()
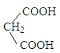 +2CH3CH2OH
+2CH3CH2OH![]()
![]() +2H2O
+2H2O ![]() +CH3NH2
+CH3NH2![]()
 +2H2O
+2H2O ![]() Лђ
Лђ![]() Лђ
Лђ![]()
ЁОНтЮіЁП
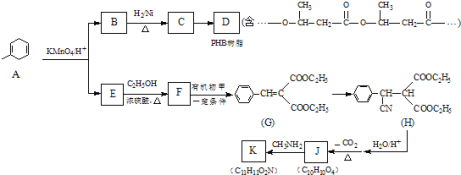
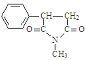
гЩаХЯЂЂкЃЌAБЛИпУЬЫсМиШмвКбѕЛЏЩњГЩBЁЂEЗжБ№ЮЊ![]() ЁЂHOOCCH2COOHжаЕФвЛжжЃЌИљОнPHBЪїжЌНсЙЙМђЪНЃЌCЗЂЩњЫѕОлЗДгІЩњГЩPHBЃЌдђCНсЙЙМђЪНЮЊ
ЁЂHOOCCH2COOHжаЕФвЛжжЃЌИљОнPHBЪїжЌНсЙЙМђЪНЃЌCЗЂЩњЫѕОлЗДгІЩњГЩPHBЃЌдђCНсЙЙМђЪНЮЊ![]() ЃЌBКЭЧтЦјЗЂЩњМгГЩЗДгІЩњГЩCЃЌBЮЊ
ЃЌBКЭЧтЦјЗЂЩњМгГЩЗДгІЩњГЩCЃЌBЮЊ![]() ЃЌЙЪEЮЊHOOCCH2COOHЃЎEгыМзДМЗЂЩњѕЅЛЏЗДгІЩњГЩFЃЌFКЭМзЗДгІЩњГЩGЃЌИљОнаХЯЂЂлМзЮЊ
ЃЌЙЪEЮЊHOOCCH2COOHЃЎEгыМзДМЗЂЩњѕЅЛЏЗДгІЩњГЩFЃЌFКЭМзЗДгІЩњГЩGЃЌИљОнаХЯЂЂлМзЮЊ![]() ЃЌFЮЊCH3CH2OOCCH2COOCH2CH3ЃЌGгыHCNЗЂЩњМгГЩЗДгІЩњГЩHЃЌHЗЂЩњЫЎНтЗДгІЁЂдйЭбШЅЗжзгЖўбѕЛЏЬМЩњГЩJЃЌ1mol JзюЖргы2molNaHCO3ЗДгІЃЌЫЕУїJжаКЌгаСНИієШЛљЃЌJКЭCH3NH2ЗДгІЩњГЩKЃЌИљОнЗжзгЪНЃЌJЗЂЩњШЁДњЗДгІЩњГЩKЃЌKЗжзгНсЙЙжаКЌгавЛИіЮхдЊЛЗгывЛИіСљдЊЛЗЃЌJжа2ИієШЛљгыCH3NH2ЭбЫЎЃЌ2ИієШЛљжЎМфЯрИє2ИіЬМдзгЃЌJНсЙЙМђЪНЮЊ
ЃЌFЮЊCH3CH2OOCCH2COOCH2CH3ЃЌGгыHCNЗЂЩњМгГЩЗДгІЩњГЩHЃЌHЗЂЩњЫЎНтЗДгІЁЂдйЭбШЅЗжзгЖўбѕЛЏЬМЩњГЩJЃЌ1mol JзюЖргы2molNaHCO3ЗДгІЃЌЫЕУїJжаКЌгаСНИієШЛљЃЌJКЭCH3NH2ЗДгІЩњГЩKЃЌИљОнЗжзгЪНЃЌJЗЂЩњШЁДњЗДгІЩњГЩKЃЌKЗжзгНсЙЙжаКЌгавЛИіЮхдЊЛЗгывЛИіСљдЊЛЗЃЌJжа2ИієШЛљгыCH3NH2ЭбЫЎЃЌ2ИієШЛљжЎМфЯрИє2ИіЬМдзгЃЌJНсЙЙМђЪНЮЊ![]() ЃЌKНсЙЙМђЪНЮЊ
ЃЌKНсЙЙМђЪНЮЊ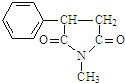 ЁЃ
ЁЃ
ЃЈ1ЃЉЭЈЙ§ЗжЮіЃЌBгыЧтЦјЗЂЩњМгГЩЗДгІЩњГЩCЃЌвВЪєгкЛЙдЗДгІЃЌЙЪД№АИЮЊЃКМгГЩЗДгІЃЈЛђЛЙдЗДгІЃЉЃЛ
ЃЈ2ЃЉCНсЙЙМђЪНЮЊ![]() ЃЌCЗЂЩњЫѕОлЗДгІЩњГЩ
ЃЌCЗЂЩњЫѕОлЗДгІЩњГЩ ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК ЃЛ
ЃЛ
ЃЈ3ЃЉЭЈЙ§ЗжЮіЃЌМзЮЊ![]() ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
ЃЈ4ЃЉEКЭввДМЗЂЩњѕЅЛЏЗДгІЩњГЩFЃЌЗДгІЗНГЬЪНЮЊЃК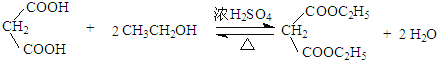 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК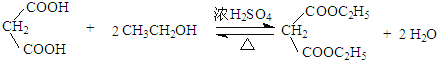 ЃЛ
ЃЛ
ЃЈ5ЃЉJНсЙЙМђЪНЮЊ![]() ЃЌKНсЙЙМђЪНЮЊ
ЃЌKНсЙЙМђЪНЮЊ ЃЌJЗЂЩњШЁДњЗДгІЩњГЩKЃЌЗДгІЗНГЬЪНЮЊ
ЃЌJЗЂЩњШЁДњЗДгІЩњГЩKЃЌЗДгІЗНГЬЪНЮЊ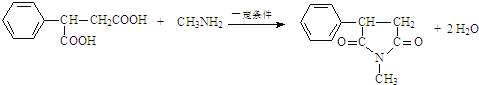 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК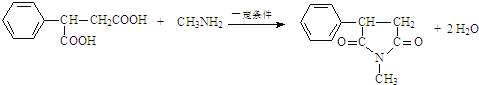 ЃЛ
ЃЛ
ЃЈ6ЃЉAНсЙЙМђЪНЮЊ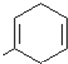 ЃЌВЛБЅКЭЖШЮЊ3ЃЌSЪЧAЕФвЛжжЭЌЗжвьЙЙЬхЃЌЗжзгжаУЛгаЛЗзДНсЙЙЃЌКЌгаКЌга3ИіЫЋМќЃЌЛђ1ИіЫЋМќЁЂ1ИіШ§МќЃЌSЕФКЫДХЙВеёЧтЦзгаШ§ИіЗхЃЌЗхУцЛ§жЎБШЮЊ6ЃК3ЃК1ЃЌдђSЕФНсЙЙМђЪНЮЊ
ЃЌВЛБЅКЭЖШЮЊ3ЃЌSЪЧAЕФвЛжжЭЌЗжвьЙЙЬхЃЌЗжзгжаУЛгаЛЗзДНсЙЙЃЌКЌгаКЌга3ИіЫЋМќЃЌЛђ1ИіЫЋМќЁЂ1ИіШ§МќЃЌSЕФКЫДХЙВеёЧтЦзгаШ§ИіЗхЃЌЗхУцЛ§жЎБШЮЊ6ЃК3ЃК1ЃЌдђSЕФНсЙЙМђЪНЮЊ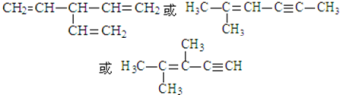 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК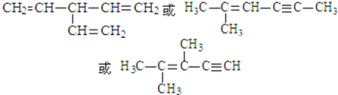 ЁЃ
ЁЃ

ЁОЬтФПЁПЬМКЭЬМЕФЛЏКЯЮядкЩњВњЁЂЩњЛюжаЕФгІгУЗЧГЃЙуЗКЃЌдкЬсГЋНЁПЕЩњЛювбГЩГБСїЕФНёЬьЃЌЁАЕЭЬМЩњЛюЁБВЛдйжЛЪЧвЛжжРэЯыЃЌИќЪЧвЛжжжЕЕУЦкД§ЕФаТЕФЩњЛюЗНЪНЃЎ
(1)НЋCO2гыНЙЬПзїгУЩњГЩCOЃЌCOПЩгУгкСЖЬњЕШЃЎ
ЂйвбжЊЃКFe2O3(s)+3C(ЪЏФЋ)ЃН2Fe(s)+3CO(g) ЁїH1ЃН+489.0kJ/mol
C(ЪЏФЋ)+CO2(g)ЃН2CO(g) ЁїH2ЃН+172.5kJ/mol
дђCOЛЙдFe2O3ЕФШШЛЏбЇЗНГЬЪНЮЊ____ЃЛ
ЂкТШЛЏюй(PdCl2)ШмвКГЃБЛгІгУгкМьВтПеЦјжаЮЂСПCOЃЎPdCl2БЛЛЙдГЩЕЅжЪЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_ЃЛ
(2)НЋСНИіЪЏФЋЕчМЋВхШыKOHШмвКжаЃЌЯђСНМЋЗжБ№ЭЈШыC3H8КЭO2ЙЙГЩБћЭщШМСЯЕчГиЃЎ
ЂйИКМЋЕчМЋЗДгІЪНЪЧЃК_____ЃЛ
ЂкФГЭЌбЇРћгУБћЭщШМСЯЕчГиЩшМЦСЫвЛжжЕчНтЗЈжЦШЁFe(OH)2ЕФЪЕбщзАжУ(ШчЭМЫљЪО)ЃЌЭЈЕчКѓЃЌШмвКжаВњЩњДѓСПЕФАзЩЋГСЕэЃЌЧвНЯГЄЪБМфВЛБфЩЋЃЎЯТСаЫЕЗЈжае§ШЗЕФЪЧ_____(ЬюађКХ)
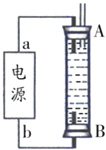
AЃЎЕчдДжаЕФaвЛЖЈЮЊе§МЋЃЌbвЛЖЈЮЊИКМЋ BЃЎПЩвдгУNaClШмвКзїЮЊЕчНтвК
CЃЎAЁЂBСНЖЫЖМБиаыгУЬњзїЕчМЋ DЃЎвѕМЋЗЂЩњЕФЗДгІЪЧЃК2H++2e-ЃНH2Ёќ
(3)НЋВЛЭЌСПЕФCO(g)КЭH2O(g)ЗжБ№ЭЈШыЬхЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаЃЌНјааЗДгІЃКCO(g)+H2O(g)CO2(g)+H2(g)ЃЌЕУЕНШчЯТШ§зщЪ§ОнЃК
ЪЕбщзщ | ЮТЖШ/Ёц | Ц№ЪМСП/mol | ЦНКтСП/mol | ДяЕНЦНКтЫљашЪБМф/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
ЂйИУЗДгІЕФе§ЗДгІЮЊ_____(ЬюЁАЮќЁБЛђЁАЗХЁБ)ШШЗДгІЃЛ
ЂкЪЕбщ2жаЃЌЦНКтГЃЪ§KЃН_____ЃЛ
ЂлЪЕбщ3ИњЪЕбщ2ЯрБШЃЌИФБфЕФЬѕМўПЩФмЪЧ_____(Д№вЛжжЧщПіМДПЩ)ЃЛ
(4)НЋ2.4gЬМдкзуСПбѕЦјжаШМЩеЃЌЫљЕУЦјЬхЭЈШы100mL 3.0mol/LЕФЧтбѕЛЏФЦШмвКжаЃЌЭъШЋЮќЪеКѓЃЌШмвКжаЫљКЌРызгЕФЮяжЪЕФСПХЈЖШгЩДѓЕНаЁЕФЫГађ_____ЃЎ