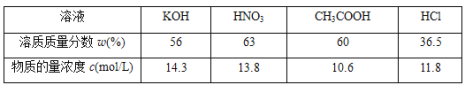
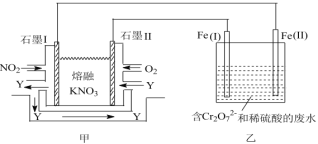
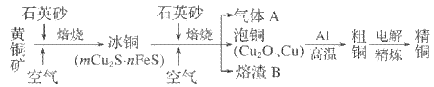
题目内容
【题目】某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法不正确的是
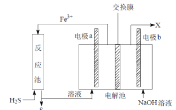
A.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
B.若交换膜为阳离子交换膜,b 电极区会产生红褐色沉淀
C.电极 a 为阳极
D.反应池中处理H2S的反应是H2S +2Fe3+ = 2Fe2+ +S↓+2H+
【答案】A
【解析】
由装置可知,反应池中的反应物为硫化氢废气与氯化铁溶液发生氧化还原反应生成硫、氯化氢和氯化亚铁,反应的化学方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl,反应生成的氯化亚铁在阳极a电极上失电子发生氧化反应生成氯化铁,生成的氯化铁进入反应池循环使用,电极b为电解池阴极,水在阴极上得电子发生还原反应生成氢气和氢氧根。
A项、若交换膜为质子交换膜,氢离子由左向右移动加入阴极室,与放电生成的氢氧根发生中和反应生成水,阴极室中NaOH溶液的浓度不变,故A错误;
B项、若交换膜为阳离子交换膜,三价铁离子由左向右移动加入阴极室,在b 电极区与氢氧根反应生成红褐色氢氧化铁沉淀,故B正确;
C项、电极 a 为阳极,氯化亚铁在阳极上失电子发生氧化反应生成氯化铁,生成的氯化铁进入反应池循环使用,故C正确;
D项、由装置可知,反应池中的反应物为硫化氢废气与氯化铁溶液发生氧化还原反应生成硫、氯化氢和氯化亚铁,反应的离子方程式为H2S +2Fe3+ = 2Fe2+ +S↓+2H+,故D正确;
故选A。

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目