题目内容
【题目】草酸(H2C2O4)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)H2C2O4 (s) ![]() H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
A.恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态
B.恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态
C.气体摩尔体积不再发生变化,说明该反应已达到化学平衡状态
D.气体平均摩尔质量不再发生变化,说明该反应已达到化学平衡状态
(2)草酸分解所需燃料可以是CO,通过甲烷制备CO:
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H >O。常温下,在2 L的密闭容器中通入4 mol CH4气体和6 mol CO2气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1 mol·L-1。
①平衡时,该反应的平均反应速率v(CO2)= mol·L-1min-1。
②在不改变反应混合物用量的前提下,为了提高CH4气体的转化率,可采取的措施是 。
(3)电解饱和草酸溶液可以制得高档香料乙醛酸(H2C2O3),装置如下图1所示,写出复合膜电极的电极反应式 。

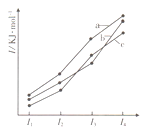
(4)在K3Fe(C2O4)3溶液中存在:[Fe(C2O4)3]3-Fe3++3C2O42-,常温下,该溶液中
[Fe(C2O4)3]3-的浓度与温度的关系如上图2所示,则A点的c(Fe3+) B点的c(Fe3+) (填“<”“>”或“=”);草酸是一种温和的还原剂,其他条件不变,向K3Fe(C2O4)3溶液中加入少量KMnO4固体,Fe3+的浓度 (填“增大”“减小”或“不变”)。
【答案】(1)K=c(H2O)·c(CO)·c(CO2); AB
(2)①0.01 ②升高温度或增大容器的体积(减小压强)
(3)H2C2O4+2H++2e-=H2C2O3+H2O(3分 )
(4)< ;增大
【解析】
试题分析:(1)反应H2C2O4 (s)H2O(g)+CO(g)+CO2(g)△H=+340kJmol-1的平衡常数表达式 K=c(H2O)c(CO)c(CO2);密闭容器中,保持温度不变,A.反应H2C2O4 (s)![]() H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态,故A正确;B.反应H2C2O4 (s)
H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态,故A正确;B.反应H2C2O4 (s)![]() H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态,故B正确;C.气体摩尔体积只与气体状态有关,当气体摩尔体积不再发生变化,不能说明该反应已达到化学平衡状态,故C错误;D.生成物气体是按照固定比例生成的,气体平均摩尔质量不发生变化,所以气体平均摩尔质量不再发生变化,不能说明该反应已达到化学平衡状态,故D错误。
H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态,故B正确;C.气体摩尔体积只与气体状态有关,当气体摩尔体积不再发生变化,不能说明该反应已达到化学平衡状态,故C错误;D.生成物气体是按照固定比例生成的,气体平均摩尔质量不发生变化,所以气体平均摩尔质量不再发生变化,不能说明该反应已达到化学平衡状态,故D错误。
(2)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)△H>O.
2CO(g)+2H2(g)△H>O.
起始(mol)4 6 0 0
变化(mol)0.1×1 0.1×1 0.1×2 0.1×2
平衡(mol)3.9 5.9 0.1×2 0.1×2
①平衡时,该反应的平均反应速率v(CO2)=0.1/2/5==0.01molL-1min-1。②反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)△H>O正反应为吸热反应,且是一个气体体积增大的反应,故升高温度或增大容器的体积(减小压强)平衡右移,CH4气体的转化率升高。(3)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为H2C2O4+2H++2e-=H2C2O3+H2O。(4)从图2所示知温度升高溶液中[Fe(C2O4)3]3-的浓度减小,[Fe(C2O4)3]3-Fe3++3C2O42-平衡右移,则A点的c(Fe3+)<B点的c(Fe3+)。草酸是一种温和的还原剂,加入少量KMnO4固体,草酸被氧化,浓度减小,平衡右移,Fe3+的浓度增大。
2CO(g)+2H2(g)△H>O正反应为吸热反应,且是一个气体体积增大的反应,故升高温度或增大容器的体积(减小压强)平衡右移,CH4气体的转化率升高。(3)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为H2C2O4+2H++2e-=H2C2O3+H2O。(4)从图2所示知温度升高溶液中[Fe(C2O4)3]3-的浓度减小,[Fe(C2O4)3]3-Fe3++3C2O42-平衡右移,则A点的c(Fe3+)<B点的c(Fe3+)。草酸是一种温和的还原剂,加入少量KMnO4固体,草酸被氧化,浓度减小,平衡右移,Fe3+的浓度增大。

 阅读快车系列答案
阅读快车系列答案