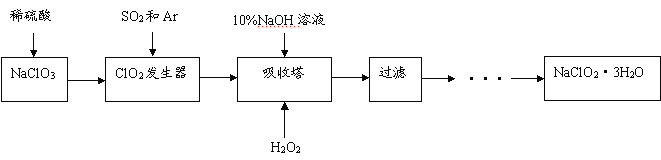
题目内容
【题目】电解精炼铜的阳极泥中含有多种贵重金属,从中提取金、银、铂的一种工艺如下:
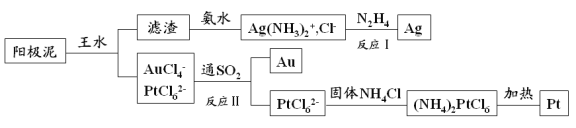
(1)王水是 的混合液,其体积比为 。
(2)滤渣的成分是 ,反应Ⅰ中肼(N2H4)的作用是 。
(3)反应Ⅱ的离子方程式为 ;当生成19.7gAu时,25℃和101kPa下反应消耗 L SO2(此条件下的气体摩尔体积为24.5L/mol,相对原子质量Au:197)。
(4)电解法精炼银时,粗银应与直流电源的 极(填“正”或“负”)相连,当用AgNO 3 和HNO 3 混合溶液做电解质溶液时,发现阴极有少量红棕色气体,则产生该现象的电极反应式为 。
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,原因是 。
【答案】(1)浓盐酸和浓硝酸,3:1
(2)AgCl,做还原剂
(3)2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+,3.675
(4)正极,2H + +NO 3 - +e - =NO 2 ↑+H 2 O。
(5)王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水。
【解析】
试题分析:粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,过滤后的氯化银滤渣用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银,滤液中通入二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,过滤得到滤液中 含PtCl62-,加入固体氯化铵得到沉淀(NH4)2PtCl6,受热分解得到金属Pt。(1)王水的组成是浓盐酸和浓硝酸按照3:1混合组成的混合物。(2)粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,过滤后的氯化银滤渣用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银。(3)依据流程转化关系,二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,依据氧化还原反应的电子守恒分析计算写出离子方程式为:2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+,当生成19.7gAu时物质的量为19.7/197=0.1mol,
3SO2~2Au
3 2
n 0.1mol
n=0.15mol
此条件下的气体摩尔体积为24.5L/mol,25℃和101kPa下反应消耗二氧化硫气体体积24.5L/mol×0.15mol=3.675g。(4)电解法精炼银时,粗银做阳极与电源正极相连,精银做阴极,含银离子的硝酸银做电解质溶液,当用AgNO3和HNO3混合溶液做电解质溶液时,发现阴极有少量红棕色气体二氧化氮生成,电极反应是在阴极上硝酸根离子被还原生成二氧化氮,电极反应为NO3-+2H++e-=NO2↑+H2O。(5)金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水。

【题目】实验室制备环己酮的反应原理:

其反应的装置示意图如下(夹持装置、加热装置略去):

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表(注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
环己酮 | 155.6(95) | 0.948 | 微溶于水 |
饱和食盐水 | 108.0 | 1.330 | |
水 | 100.0 | 0.998 |
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
① 仪器B的名称是 。
② 蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
③ 蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~ 156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
① 上述操作的正确顺序是 (填序号)。
② 在上述操作c中,加入NaCl固体的作用是 。
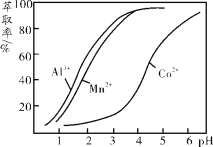
(3)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如上图。现有某钴矿石的盐酸浸出液, 浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+ 后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围控制在 。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(4)在实验中原料用量:20mL环己醇、酸性Na2Cr2O7溶液10mL,最终称得产品质量为14.7g,则所得环己酮的产率为 (百分数精确到0.1)。
(5)实验产生的含铬废液易污染环境,可将Cr2O72-转化为Cr3+,再转化为Cr(OH)3沉淀除去,为使Cr3+浓度小于1×10-5mol/L,应调节溶液的pH=___________。(已知该条件下Cr(OH)3的Ksp是6.4×10-31, lg2=0.3 lg5=0.7)