题目内容
【题目】(1)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂,实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
a.将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
b.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
c.趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
d.待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
e.将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
①实验步骤b明显不合理,理由是 。
②实验步骤d中用少量冰水洗涤晶体,其目的是 , 。
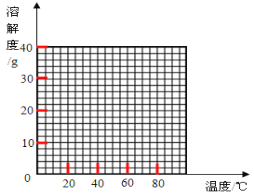
(2)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。硫酸亚铁的溶解度和析出晶体的组成
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
(3)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为 .
![]() (4)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
(4)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
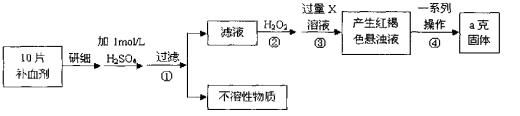
请回答下列问题:
①证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
②步骤④中一系列处理的操作步骤:过滤、 、灼烧、
③若实验无损耗,则每片补血剂含铁元素的质量 g。
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,请写出该反应的化学方程式 。
【答案】(1)①应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在
②洗涤可以除去晶体表面附着的硫酸等杂质;用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗。
(2)
(3)56.7℃ < t < 64℃
(4)①氯水(或双氧水、稀硝酸等合理氧化剂)
现象:或溶液由浅绿色变为血红色
②洗涤、冷却 ③0.07a ④5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O
【解析】
试题分析:(1)①因亚铁离子易被氧化,加Fe可防止氧化,所以实验步骤b明显不合理,理由是铁耗尽会使亚铁离子被氧化,从而导致溶液中可能有Fe3+存在。
②晶体表面有附着的硫酸等杂质,洗涤可以除去晶体表面附着的硫酸等杂质;又因为温度低,晶体的溶解度小,因此少量冰水洗涤的另一个目的是用降低洗涤过程中FeSO4·7H2O的损耗。
(2)依据图表数据分析,析出晶体FeSO44H2O的温度范围应为56.7℃<t<64℃;结合图表中溶解度随温度的变化,用描点法绘制变化曲线图,注意温度做横坐标,溶解度做纵坐标,画出图象为(见答案)。
(3)根据表中数据可知若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为56.7℃<t<64℃;
(4)①亚铁离子具有还原性,证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加氯水,氯水把亚铁离子氧化为铁离子,铁离子与KSCN溶液反应显血红色,则该过程的现象为溶液由浅绿色变为血红色。
②步骤④中一系列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量。
③若实验无损耗,则根据铁原子守恒可知每片补血剂含铁元素的质量 。
。
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,该反应的化学方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O。

【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1) A、B、D、E、F的原子半径由大到小排列的顺序为__________(用元素符号表示)
(2) 工业制备F单质的离子反应方程式为_________________。
(3) 由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 由D和E构成,且原子数之比为1:1 |
c | 化学组成EDF |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式 ;b的化学键类型 ;
c的一种作用 ;d的晶体类型 。
(4) 由A和B、D元素组成的两种二元化合物形成一类新能源物质。其中一种化合物分子通过 键构成具有空腔的固体;另一种化合物分子进入该空腔,形成可燃固体。