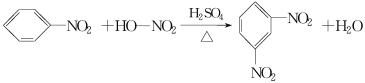题目内容
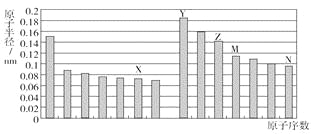
【题目】右图三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是( )

A. 电负性:c>b>a B. 最简单氢化物的稳定性:c>a>b
C. I5:a>c>b D. 最简单氢化物的沸点:a>b>c
【答案】C
【解析】试题分析:A.根据碳、硅、磷元素的原子核外电子排布规律,结合其第一电离能可知:a是碳;b是磷;c是硅。A.元素的非金属越强,其电负性就越小,由于元素的非金属性:P>C>Si,所以元素的电负性:c<b<a,错误;B.元素的非金属性越强,其最简单氢化物的稳定性就越强。由于元素的非金属性:P>C>Si,所以最简单氢化物的稳定性c< a < b,错误;C.当碳原子失去第5个电子时形成的是1s1半充满的稳定结构,P元素形成的是2s22p6的全充满的稳定结构,而硅元素形成的是2s22p5的不稳定结构,所以元素的I5:a>c>b,正确;D.对于结构相似的物质来说,相对分子质量越大,分子间作用力越大,物质的熔点、沸点就越高。由于相对分子质量PH3>SiH4>CH4,所以最简单氢化物的沸点:b>c >a,错误。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案【题目】实验室制备环己酮的反应原理:

其反应的装置示意图如下(夹持装置、加热装置略去):

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表(注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
环己酮 | 155.6(95) | 0.948 | 微溶于水 |
饱和食盐水 | 108.0 | 1.330 | |
水 | 100.0 | 0.998 |
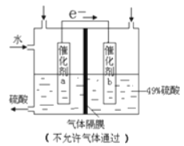
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
① 仪器B的名称是 。
② 蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
③ 蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~ 156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
① 上述操作的正确顺序是 (填序号)。
② 在上述操作c中,加入NaCl固体的作用是 。
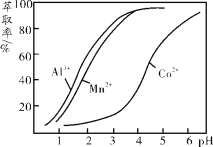
(3)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如上图。现有某钴矿石的盐酸浸出液, 浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+ 后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围控制在 。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(4)在实验中原料用量:20mL环己醇、酸性Na2Cr2O7溶液10mL,最终称得产品质量为14.7g,则所得环己酮的产率为 (百分数精确到0.1)。
(5)实验产生的含铬废液易污染环境,可将Cr2O72-转化为Cr3+,再转化为Cr(OH)3沉淀除去,为使Cr3+浓度小于1×10-5mol/L,应调节溶液的pH=___________。(已知该条件下Cr(OH)3的Ksp是6.4×10-31, lg2=0.3 lg5=0.7)
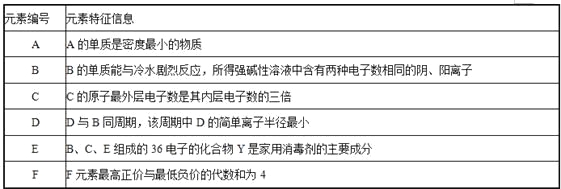
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1) A、B、D、E、F的原子半径由大到小排列的顺序为__________(用元素符号表示)
(2) 工业制备F单质的离子反应方程式为_________________。
(3) 由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 由D和E构成,且原子数之比为1:1 |
c | 化学组成EDF |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式 ;b的化学键类型 ;
c的一种作用 ;d的晶体类型 。
(4) 由A和B、D元素组成的两种二元化合物形成一类新能源物质。其中一种化合物分子通过 键构成具有空腔的固体;另一种化合物分子进入该空腔,形成可燃固体。