题目内容
14.设NA代表阿伏伽德罗常数,些列说法正确的是( )| A. | 42g C3H6中含有的共用电子对数目为8NA | |
| B. | 2g CaCO3和8g KHCO3组成的混合物中碳原子数为0.1 NA | |
| C. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA | |
| D. | 1L 0.01mol•L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA |
分析 A.C3H6中含有9g共用电子对,根据n=$\frac{m}{M}$计算出C3H6的物质的量,再计算出含有的共用电子对数;
B.碳酸钙和碳酸氢钾的摩尔质量都是40g/mol,化学式中都含有1个C原子,根据n=$\frac{m}{M}$计算出混合物的物质的量,再计算出含有的碳原子数;
C.稀有气体为单原子分子,1mol氦气中含有1mol原子;
D.根据n=cV计算出溶质硫酸铝钾的物质的量,铝离子部分水解,导致阳离子数目增多.
解答 解:A.42g C3H6中物质的量=$\frac{42g}{42g/mol}$=1mol,而1mol丙烯中含9mol共用电子对,故共用电子对数目为9nA,故A错误;
B.碳酸钙和碳酸氢钾的摩尔质量都是40g/mol,2g CaCO3和8g KHCO3组成的混合物的物质的量为:$\frac{2g+8g}{100g/mol}$=0.1mol,0.1mol混合物中含有0.1molC原子,含有的碳原子数为0.1 NA,故B正确;
C.标况下22.4L气体的物质的量为1mol,1mol氦气中含有1mol氦原子,1mol氟气中含有2mol氟原子,二者含有的原子数不同,故B错误;
D.1L 0.01mol•L-1 KAl(SO4)2溶液中含有0.01mol硫酸铝钾,由于铝离子部分水解,则溶液中含有的阳离子的物质的量大于0.02mol,含有的阳离子数目大于0.02 NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系,B为易错点,注意稀有气体为单原子分子.

练习册系列答案
相关题目
4.节日里,小朋友们玩的荧光棒的发光原理是:化学物质相互反应过程中,能量以光的形式释放出来.发荧光棒放在热水中,荧光棒会更亮,原因之一是( )
| A. | 反应物浓度减小,反应速率减小 | |
| B. | 反应物浓度增加,反应速率增加 | |
| C. | 温度升高,反应速率增加 | |
| D. | 热水对反应起催化作用,从而加快了反应速率 |
5.氨水的碱性较弱,其原因是( )
| A. | 它能使酚酞试液变红色 | |
| B. | 氨水极易挥发出氨 | |
| C. | 氨与水结合生成的一水合氨(NH3•H2O)只有小部分电离成NH4+和OH- | |
| D. | 溶于水的氨大部分以NH3分子形式存在 |
2.某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2g H2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 此有机物的最简式为CH4O |
18.用下列装置进行相应实验,能达到实验目的是( )


| A. | 图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 图3所示装置配制100mL0.1mol•L-1的硫酸 | |
| D. | 图4所示装置用于分离出溴苯 |
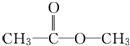 、
、 或
或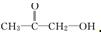 .
.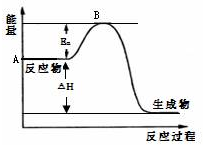 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1molSO2(g)完全转化为1molSO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1molSO2(g)完全转化为1molSO3(g)放热99kJ.请回答: