题目内容
19.质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的H原子数成正比.化学式为C3H6O2的二元混合物,如果在PMR谱上观察到的氢原子给出的峰有两种情况.第一种情况峰给出的强度比为3:3;第二种情况峰的强度比为3:2:1,由此可推断混合物的组成可能是(写结构简式)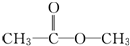 、
、 或
或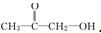 .
.
分析 核磁共振氢谱中信号峰强度之比等于化学环境不同H原子数目之比,第一种峰强度为3:3,说明有2个-CH3;第二种峰强度为3:2:1,说明结构中含有3种不同性质的氢,其个数分别为3、2,结合分子式和峰值强度之比写出结构简式.
解答 解:有机物(C3H6O2),峰值强度之比为3:3,则含有2种H原子,且个数之比是3:3,说明有2个-CH3,化合物的结构简式为 ;
;
第二种峰强度为3:2:1,说明结构中含有3种不同性质的氢,其个数分别为3、2、1,结构简式可能为 或
或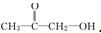
故答案为: 、
、 或
或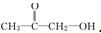
点评 本题考查了分子式的确定,核磁共振氢谱、结构简式的书写等知识,难度中等,注意核磁共振氢谱中有几个不同的峰,分子中就有几种H原子.

练习册系列答案
相关题目
9.下列说法错误的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |
10.下列关于元素周期表的说法正确的是( )
| A. | 元素周期表共有七个周期 | |
| B. | 元素周期表共有18个族 | |
| C. | 所含元素种数最多的族是 VIII族 | |
| D. | 第三周期元素的原子核外都有三个电子层 |
7.在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄露入潮湿的土壤中,并与金属管道或铁轨形成回路时.就会引起后者的腐蚀.原理简化如图所示.则下列有关说法不正确的是( )


| A. | 原理图可理解为两个串联电解装置 | |
| B. | 溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 | |
| C. | 溶液中铁丝左端电极反应式为:Fe-2e-═Fe2+ | |
| D. | 地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
14.设NA代表阿伏伽德罗常数,些列说法正确的是( )
| A. | 42g C3H6中含有的共用电子对数目为8NA | |
| B. | 2g CaCO3和8g KHCO3组成的混合物中碳原子数为0.1 NA | |
| C. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA | |
| D. | 1L 0.01mol•L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA |
6.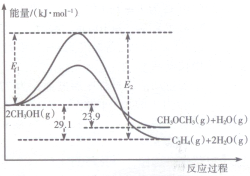 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
3.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g).按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:下列说法不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)}$ | |
| C. | 2c1<1.5 | |
| D. | 2ρ1=ρ2 |
4.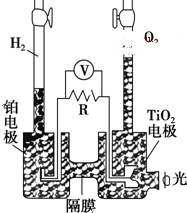 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| B. | 该装置工作时,TiO2电极附近溶液的pH变大 | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 |